早教吧作业答案频道 -->化学-->
工业上利用软锰矿(主要成分为MnO2)用来制备“锰白”(MnCO3)和电极材料锰酸锂(LiO2•2MnO2•Mn2O3),期其工艺流程如图:(1)“浸出”过程中SO2作用是.(2)为使原料充分利用,滤液
题目详情
工业上利用软锰矿(主要成分为MnO2)用来制备“锰白”(MnCO3)和电极材料锰酸锂(LiO2•2MnO2•Mn2O3),期其工艺流程如图:
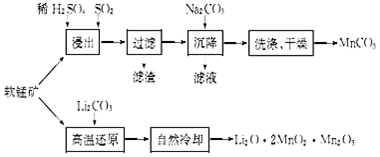
(1)“浸出”过程中SO2作用是___.
(2)为使原料充分利用,滤液中c(Mn2+)应当小于___ mol•L-1.已知:常温下MnCO3的Kap=9.0×10-12.
(3)写出软锰矿与Li2CO3发生“高温还原”的化学方程式:___.
(4)锰酸锂((LiO2•2MnO2•Mn2O3,M=362g•mol-1)中掺入LiMnO2能大幅提高电容量,实验室测定某电极材料中两者配比的操作步骤如下;准确称取2.012g的试样于锥形瓶中,加入5mL稀硫酸充分溶解;向上述所得溶液中加入10.00mL2.000mol•L-1草酸钠(Na2C2O4)标准溶液,搅拌至溶液清亮,并定容至250mL;从容量瓶中取出25.00mL溶液,用0.01mol•L-1KMnO4标准溶液滴定,消耗KMnO4标准溶液20.00mL.
通过计算两者物质的量之比(写出计算过程).
已知实验中设计的相关氧化还原反应如下:
①Mn2++C2O42-→Mn2++2CO2↑②Mn4++C2O42-→Mn2++2CO2↑③MnO4-+C2O42-+H+→Mn2++2CO2↑(均未配平)

(1)“浸出”过程中SO2作用是___.
(2)为使原料充分利用,滤液中c(Mn2+)应当小于___ mol•L-1.已知:常温下MnCO3的Kap=9.0×10-12.
(3)写出软锰矿与Li2CO3发生“高温还原”的化学方程式:___.
(4)锰酸锂((LiO2•2MnO2•Mn2O3,M=362g•mol-1)中掺入LiMnO2能大幅提高电容量,实验室测定某电极材料中两者配比的操作步骤如下;准确称取2.012g的试样于锥形瓶中,加入5mL稀硫酸充分溶解;向上述所得溶液中加入10.00mL2.000mol•L-1草酸钠(Na2C2O4)标准溶液,搅拌至溶液清亮,并定容至250mL;从容量瓶中取出25.00mL溶液,用0.01mol•L-1KMnO4标准溶液滴定,消耗KMnO4标准溶液20.00mL.
通过计算两者物质的量之比(写出计算过程).
已知实验中设计的相关氧化还原反应如下:
①Mn2++C2O42-→Mn2++2CO2↑②Mn4++C2O42-→Mn2++2CO2↑③MnO4-+C2O42-+H+→Mn2++2CO2↑(均未配平)
▼优质解答
答案和解析
(1)向软锰矿(主要成分为MnO2)中加入稀硫酸并通入二氧化硫,MnO2与SO2作用生成硫酸锰,二氧化硫将MnO2还原为Mn2+;
故答案为:将MnO2还原为Mn2+;
(2)已知:常温下MnCO3的Kap=c(Mn2+)•c(CO32-)=9.0×10-12,c(Mn2+)=c(CO32-),则c(Mn2+)≤
mol/L=3.0×10-6;
故答案为:3.0×10-6;
(3)软锰矿与Li2CO3得LiO2•2MnO2•Mn2O3,锰元素化合价降低,则氧元素化合价升高有氧气生成,化学反应为:2Li2CO3+8MnO2
LiO2•2MnO2•Mn2O3+2CO2↑+O2↑;
故答案为:2Li2CO3+8MnO2
LiO2•2MnO2•Mn2O3+2CO2↑+O2↑;
(4)n(KMnO4)=0.01mol•L-1×0.02L×(250÷25)=0.002mol,
n(Na2C2O4)=2mol•L-1×0.01L=0.02mol,
设LiO2•2MnO2•Mn2O3物质的量为x,LiMnO2的物质的量为y,
362g•mol-1×x+94g•mol-1×y=2.012g,
由电子守恒:6x+y+0.02mol×5=0.04mol
解得:x=0.004mol y=0.006mol,
故n(LiO2•2MnO2•Mn2O3):n(LiMnO2)=2:3;
答:锰酸锂((LiO2•2MnO2•Mn2O3)与LiMnO2物质的量之比2:3.
故答案为:将MnO2还原为Mn2+;
(2)已知:常温下MnCO3的Kap=c(Mn2+)•c(CO32-)=9.0×10-12,c(Mn2+)=c(CO32-),则c(Mn2+)≤
| 9.0×10-12 |
故答案为:3.0×10-6;
(3)软锰矿与Li2CO3得LiO2•2MnO2•Mn2O3,锰元素化合价降低,则氧元素化合价升高有氧气生成,化学反应为:2Li2CO3+8MnO2
| ||
故答案为:2Li2CO3+8MnO2
| ||
(4)n(KMnO4)=0.01mol•L-1×0.02L×(250÷25)=0.002mol,
n(Na2C2O4)=2mol•L-1×0.01L=0.02mol,
设LiO2•2MnO2•Mn2O3物质的量为x,LiMnO2的物质的量为y,
362g•mol-1×x+94g•mol-1×y=2.012g,
由电子守恒:6x+y+0.02mol×5=0.04mol
解得:x=0.004mol y=0.006mol,
故n(LiO2•2MnO2•Mn2O3):n(LiMnO2)=2:3;
答:锰酸锂((LiO2•2MnO2•Mn2O3)与LiMnO2物质的量之比2:3.
看了 工业上利用软锰矿(主要成分为...的网友还看了以下:
一元一次方程(要移项):(1)2分之1y-2+6分之1y-2-3分之1y+3分之2=1(2)3一元 2020-04-27 …
高一化学高锰酸钾分解方程式的单线桥怎么画?2KMno4=K2Mno4+Mno2+o2此方程式的单线 2020-05-13 …
数学.解方程组,帮帮忙吧,~{2(x-2)+2=-2和{3分之(x-1)-2分之(-1-x数学.解 2020-05-13 …
辉铜矿主要成分是Cu2S,杂质是Fe2O3、SiO2及一些不溶性物质。某课题组以辉铜矿为原料制备碱 2020-06-09 …
锰酸根的得失电子问题!答得好有追分!锰酸根和高锰酸根都是MnO4,高锰酸根和锰酸根的得失电子是怎么 2020-06-14 …
黄豆中各种营养的含量(每100克食品的含量)如下表:铁8.2毫克锰2.26毫克锌3.34毫克铜1. 2020-07-05 …
已知下列关于x的分式方程:方程一:1/x-1=2/x;方程二:2/x=3/x+1;方程三:3/x+ 2020-07-13 …
递等式:12×(8分之1+4分之3-6分之1)45÷(5分之2÷15分之1)6×12分之7-2分之 2020-07-19 …
已知下列关于x的分式方程方程11x-1=2x方程22x=3x+1方程33x+1=4x+2(1)填空: 2020-10-31 …
理科数学解一元一次方程(1)解方程2分之x加4减x加5=3分之x加3减6分之x减2(2)鲆方程21分 2020-11-21 …