早教吧作业答案频道 -->化学-->
锂元素被誉为“能源元素”.锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用.Ⅰ锂的原子结构示意图为;锂暴露在湿空气中时,会迅速地
题目详情
锂元素被誉为“能源元素”.锂及锂盐具有的优异性能和特殊功能,在化工、电子、宇航、核能、能源等领域都得到广泛应用.
Ⅰ锂的原子结构示意图为___;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式___.
Ⅱ下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.
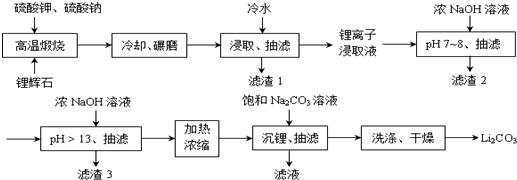
①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4═K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4═Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
④Li2SO4、Li2CO3在不同温度下的溶解度(g/100g水)
(1)浸取时使用冷水的原因是___.
(2)滤渣2的主要成分为___.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是___,用离子方程式表示其产生的原因___.
(4)加热浓缩的作用是___.
(5)洗涤Li2CO3晶体使用___.
Ⅰ锂的原子结构示意图为___;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式___.
Ⅱ下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.

①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4═K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4═Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10℃ | 20℃ | 50℃ | 80℃ |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(2)滤渣2的主要成分为___.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是___,用离子方程式表示其产生的原因___.
(4)加热浓缩的作用是___.
(5)洗涤Li2CO3晶体使用___.
▼优质解答
答案和解析
I.锂的原子核外有2个电子层,各层电子数为2、1,原子结构示意图为: ,Li与氮气反应生成Li3N,反应方程式为:6Li+N2=2Li3N,
,Li与氮气反应生成Li3N,反应方程式为:6Li+N2=2Li3N,
故答案为: ;6Li+N2=2Li3N;
;6Li+N2=2Li3N;
Ⅱ.锂辉石(Li2O•Al2O3•4SiO2)煅烧后,冷却、研磨,有利于冷水的浸取,抽滤,得到滤渣为硅酸盐,结合锂离子浸取液中含有的金属离子、离子沉淀完全pH,可知加热NaOH浓溶液,调节溶液pH=7~8,Al3+、Fe3+转化为Al(OH)3、Fe(OH)3,抽滤后再加入NaOH浓溶液,调节溶液pH>13,应是将Mn2+转化为沉淀,抽滤后,加热浓缩,加入饱和碳酸钠溶液,由于Li2CO3的溶解度远小于Li2SO4,会析出Li2CO3,由于Li2CO3的溶解度随温度升高而减小,用热水洗涤可减少Li2CO3的损失,得到最终产物碳酸锂.
(1)Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率,故用冷水浸取,
故答案为:Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率;
(2)由上述分析可知,滤渣2为Al(OH)3、Fe(OH)3,
故答案为:Al(OH)3、Fe(OH)3;
(3)只加一次浓NaOH溶液使pH>13,会使溶液中Al3+转化为AlO2-,放置后,空气中二氧化碳与AlO2-、水反应生成Al(OH)3,Li2CO3产品中的杂质可能是Al(OH)3,相应的离子方程式为:Al3++4OH-=AlO2-+2H2O、2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:Al(OH)3;Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(4)Li2CO3的溶解度随温度升高而减小,加热浓缩,提高Li+ 浓度和溶液温度,使得Li2CO3容易析出,
故答案为:提高Li+浓度和溶液温度,使得Li2CO3容易析出;
(5)Li2CO3的溶解度随温度升高而减小,用热水洗涤可以减少碳酸锂的损耗,
故答案为:热水.
 ,Li与氮气反应生成Li3N,反应方程式为:6Li+N2=2Li3N,
,Li与氮气反应生成Li3N,反应方程式为:6Li+N2=2Li3N,故答案为:
 ;6Li+N2=2Li3N;
;6Li+N2=2Li3N;Ⅱ.锂辉石(Li2O•Al2O3•4SiO2)煅烧后,冷却、研磨,有利于冷水的浸取,抽滤,得到滤渣为硅酸盐,结合锂离子浸取液中含有的金属离子、离子沉淀完全pH,可知加热NaOH浓溶液,调节溶液pH=7~8,Al3+、Fe3+转化为Al(OH)3、Fe(OH)3,抽滤后再加入NaOH浓溶液,调节溶液pH>13,应是将Mn2+转化为沉淀,抽滤后,加热浓缩,加入饱和碳酸钠溶液,由于Li2CO3的溶解度远小于Li2SO4,会析出Li2CO3,由于Li2CO3的溶解度随温度升高而减小,用热水洗涤可减少Li2CO3的损失,得到最终产物碳酸锂.
(1)Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率,故用冷水浸取,
故答案为:Li2SO4的溶解度随温度升高而减少,用冷水浸取可以提高浸取率;
(2)由上述分析可知,滤渣2为Al(OH)3、Fe(OH)3,
故答案为:Al(OH)3、Fe(OH)3;
(3)只加一次浓NaOH溶液使pH>13,会使溶液中Al3+转化为AlO2-,放置后,空气中二氧化碳与AlO2-、水反应生成Al(OH)3,Li2CO3产品中的杂质可能是Al(OH)3,相应的离子方程式为:Al3++4OH-=AlO2-+2H2O、2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,
故答案为:Al(OH)3;Al3++4OH-=AlO2-+2H2O;2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-;
(4)Li2CO3的溶解度随温度升高而减小,加热浓缩,提高Li+ 浓度和溶液温度,使得Li2CO3容易析出,
故答案为:提高Li+浓度和溶液温度,使得Li2CO3容易析出;
(5)Li2CO3的溶解度随温度升高而减小,用热水洗涤可以减少碳酸锂的损耗,
故答案为:热水.
看了 锂元素被誉为“能源元素”.锂...的网友还看了以下:
读图,河北石家庄1960~1999年累计平均沙尘暴、扬沙、浮尘出现的季节变化示意图,完成下列各题: 2020-07-16 …
读江南丘陵某地区等高线地形图,回答下列各题。1.当该地区普降暴雨时,水位上涨最猛的是A.①河B.②河 2020-11-23 …
阅读下列材料,回答有关问题。材料一非洲部分地区水系和等高线地形图材料二非洲局部地区降水量图材料三近年 2020-12-06 …
2012年6月29日12时35分,6名暴徒突然持可燃物和凶器,从飞机机舱前部和中部冲击驾驶舱、袭击机 2020-12-07 …
读世界洪涝灾害主要地区分布图。完成8~10题。8.关于洪水和洪灾,下列叙述中正确的是A.没有暴雨和大 2020-12-10 …
(共13分)读下面两图,回答问题。(1)图甲中1、2两地和图乙中阴影区域表示的农业地域类型分别是和。 2020-12-20 …
2014年5月9日以来,华南地区东部出现强降雨过程,部分地区大到暴雨,局部地区大暴雨,并伴有雷暴、短 2020-12-29 …
自然灾害与防治依据图文资料,分析图示地区雷暴空间分布特点形成的自然原因,并列举其防御措施.材料一雷暴 2021-01-05 …
[选修5一自然灾害与防治]下图示意我国西北地区多年平均年大风(>8级)日数及年沙暴日数,读图回答下列 2021-01-13 …
图是2012年第23号强热带风暴“山神”10月29日08时的中心位置(图中A)及未来24小时局地降水 2021-01-16 …