早教吧作业答案频道 -->化学-->
元素周期表是学习化学的重要工具,它隐含着许多信息和规律.如表所列是几种短周期元素的原子半径及主要化合价:元素(或元素代码)铍ABCDEF原子半径(10-10m)
题目详情
元素周期表是学习化学的重要工具,它隐含着许多信息和规律.如表所列是几种短周期元素的原子半径及主要化合价:
(1)A元素处于周期表中的位置是___.
(2)写出D离子的结构示意图___.
(3)上述A~F六种元素最高价氧化物对应水化物中酸性最强的是___(填化学式).
(4)C元素气态氢化物的电子式为___.它与C元素最高价氧化物水化物反应的生成物是属于___(离子或共价)化合物,其中含有的化学键类型有___.
(5)B的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为___.
(6)元素E与元素F对比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___(填选项字母).
A.气态氢化物水溶液的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.气态氢化物的稳定性.
| 元素(或元 素代码) | 铍 | A | B | C | D | E | F |
| 原子半径 (10-10m) | 0.89 | 1.60 | 1.43 | 0.75 | 0.74 | 1.02 | 0.99 |
| 最高价态 | +2 | +2 | +3 | +5 | - | +6 | +7 |
| 最低价态 | - | - | - | -3 | -2 | -2 | -1 |
(2)写出D离子的结构示意图___.
(3)上述A~F六种元素最高价氧化物对应水化物中酸性最强的是___(填化学式).
(4)C元素气态氢化物的电子式为___.它与C元素最高价氧化物水化物反应的生成物是属于___(离子或共价)化合物,其中含有的化学键类型有___.
(5)B的最高价氧化物的水化物与E的最高价氧化物的水化物反应的离子方程式为___.
(6)元素E与元素F对比,非金属性较强的是___(用元素符号表示),下列表述中能证明这一事实的是___(填选项字母).
A.气态氢化物水溶液的酸性 B.气态氢化物的沸点
C.单质与氢气反应的难易程度 D.气态氢化物的稳定性.
▼优质解答
答案和解析
由于A的最高正价为+2,无最低负价,故和铍同一主族,故为Mg;B的最高正价为+3价,且半径比Mg小,比铍大,故为Al;C的最高正价为+5价,最低负价为-3价,且半径比铍还小,故为第二周期的N;D的最低负价为-2价,无最高正价,且半径比铍小,故为O;E的最高正价为+6,最低负价为-2价,故和O同为第VIA族,故为S;F的最高正价为+7,最低负价为-1价,故为第VIIA族,且由于原子半径比铍大,故为Cl,
(1)A为Mg,原子核外有3个电子层,最外层有2个电子,故A在周期表中的位置为第三周期第IIA族,故答案为:第三周期第IIA族;
(2)D离子为O2-,核外有10个电子,核内有8个质子,故结构示意图为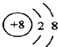 ,故答案为:
,故答案为: ;
;
(3)元素的非金属性越强,则最高价含氧酸的酸性越强,而上述A~F六种元素中非金属性最强的为Cl,故其最高价含氧酸HClO4的酸性最强,故答案为:HClO4;
(4)C元素气态氢化物为NH3,电子式为: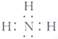 ,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,而硝酸铵属于铵盐,为离子化合物,结构中含离子键和共价键,故答案为:
,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,而硝酸铵属于铵盐,为离子化合物,结构中含离子键和共价键,故答案为: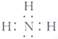 ;离子;离子键、共价键;
;离子;离子键、共价键;
(5)B的最高价氧化物的水化物为氢氧化铝,E的最高价氧化物的水化物为硫酸,两者发生酸碱中和,离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(6)同一周期的元素从左到右,非金属性逐渐增强,故Cl的非金属性强于S;且非金属性越强,单质和氢气化合越容易,得到的气态氢化物越稳定,但对氢化物溶于水后的酸性和沸点无关,故答案为:Cl;CD.
(1)A为Mg,原子核外有3个电子层,最外层有2个电子,故A在周期表中的位置为第三周期第IIA族,故答案为:第三周期第IIA族;
(2)D离子为O2-,核外有10个电子,核内有8个质子,故结构示意图为
 ,故答案为:
,故答案为: ;
;(3)元素的非金属性越强,则最高价含氧酸的酸性越强,而上述A~F六种元素中非金属性最强的为Cl,故其最高价含氧酸HClO4的酸性最强,故答案为:HClO4;
(4)C元素气态氢化物为NH3,电子式为:
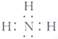 ,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,而硝酸铵属于铵盐,为离子化合物,结构中含离子键和共价键,故答案为:
,最高价氧化物水化物为硝酸,两者反应生成硝酸铵,而硝酸铵属于铵盐,为离子化合物,结构中含离子键和共价键,故答案为: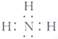 ;离子;离子键、共价键;
;离子;离子键、共价键;(5)B的最高价氧化物的水化物为氢氧化铝,E的最高价氧化物的水化物为硫酸,两者发生酸碱中和,离子方程式为:Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+3H+=Al3++3H2O;
(6)同一周期的元素从左到右,非金属性逐渐增强,故Cl的非金属性强于S;且非金属性越强,单质和氢气化合越容易,得到的气态氢化物越稳定,但对氢化物溶于水后的酸性和沸点无关,故答案为:Cl;CD.
看了 元素周期表是学习化学的重要工...的网友还看了以下:
我国的瓷器举世闻名,普通陶瓷中含有铝元素,其元素符号为,该元素氧化物的化学式为(并请标出其中铝元素 2020-04-11 …
逻辑推理是一种重要的科学思维方法,下列推理合理的是()A.因为酸与碱反应生成盐和水,所以生成盐和水 2020-05-13 …
逻辑推理是一种重要的化学思维方法.以下推理正确的是()A.酸碱中和反应有水生成,有水生成的反应一定 2020-05-14 …
X、Y元素所形成两种化合物C1、C2.C1中含X元素75%,含Y元素25%;C2中含X元素80%, 2020-05-16 …
1)尿素CO(NH2)2[这里的2都是在右下角]净重:50kg含氮量:45.8%XXX化学公司求:一 2020-12-02 …
1.硫酸钾中各元素的质量比;2.该钾肥中钾元素的含量最高为多少?信息:主要成分:K2SO4(数字2和 2020-12-02 …
X,Y元素能形成两种化合物A1和A2,其中A1中含X元素50%,含Y元素50%;A2中含X元素80% 2020-12-02 …
右图为某化肥的包装袋上的部分内容(比较急,就不画图了,把内容说一下)下为内容尿素CO(NH2)2净重 2020-12-05 …
(2008?扬州)我国的瓷器举世闻名,普通陶瓷中含有铝元素,其元素符号为,该元素氧化物的化学式为(并 2020-12-07 …
如图是某元素及其重要化合物的相互转化关系图(生成物中不含该元素的物质均已略去),图中A是单质,D在常 2020-12-22 …