硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:回答下列问题:(1)写
硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
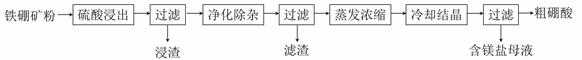
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式_____________。为提高浸出速率,除适当增加硫酸浓度浓度外,还可采取的措施有_________(写出两条)。
(2)利用 的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______(写化学式)。
(3)“净化除杂”需先加H2O2溶液,作用是_______。然后再调节溶液的pH约为5,目的是________。
(4)“粗硼酸”中的主要杂质是 (填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为_______。
(6)单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程___________。
【答案】(1)Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3;减小铁硼矿粉粒径、提高反应温度。
2MgSO4+2H3BO3;减小铁硼矿粉粒径、提高反应温度。
(2)Fe3O4; SiO2和CaSO4;
(3)将Fe2+氧化为Fe3+;使Al3+与Fe3+形成氢氧化物而除去。
(4)(七水)硫酸镁
(5)
(6)2H3BO3 ![]() B2O3+3HO B2O3+3Mg
B2O3+3HO B2O3+3Mg ![]() 3MgO+2B
3MgO+2B
【解析】(1)问写化学方程式,是仿照碱式碳酸盐和酸的反应,但是要先分析Mg2B2O5·H2O 中硼元素的化合价为+3价,联系到流程图最终产物可推知:硼元素变为H3BO3(H3BO3为弱酸,易溶于水);这不是氧化还原反应,故镁元素转化为硫酸镁。加快反应速率可以采用升温等措施,增大固体颗粒的接触面积也是中学常规。
(2)体系中有磁性只有Fe3O4,故填写Fe3O4(中学所学反应可能困扰考生)。剩下的不溶物除了SiO2还有CaSO4。
(3)先将溶液中的Fe2+氧化为Fe3+,再调节溶液的pH可以除去溶液中的Al3+和Fe3+,这是高三经常训练的除杂方法。
(4)题中讲到含硫酸镁的母液,应该容易想到硫酸镁也会结晶析出,只是晶体含有七个结晶水不容易想到(从七水硫酸锌,七水硫酸亚铁联想),讲硫酸镁晶体应该也可以。
(5)硼氢化钠的电子式很不常规,电子式是由离子键和阴离子内部的共价键两部分合成。
(6)做题时这样想,这个反应的温度应该比较高,所以H3BO3会分解,然后就是置换反应。再将化学方程式配平就好。
【考点定位】元素及其化合物知识;化学工艺常识;物质结构。本题是以化学工艺为素材,选材冷僻,试题难度为很难等级。
这首歌的中文翻译? 歌名叫:here i amHere I am - this is meTher 2020-05-16 …
it's spring.it's ()and().i wear() it's autum.it's 2020-05-17 …
下列程序段执行后s值为:(38)int i=1, s=0; do { if(!(i%2))conti 2020-05-26 …
复数名词通常加s,尾部为s,ss,sh,x的加es,尾部为y改为i加es但是y前是aei复数名词通 2020-06-07 …
r是共用体,定义*s=&r;依次定义s->i[0]=ox39;s->i[1]=ox38;为什么输出 2020-06-14 …
i是虚数单位,若集合S={-1,0,1},则()A.i属于SB.i的二次方属于SC.i的i是虚数单 2020-07-30 …
下面是求1~1000内所有偶数的和的程序,把程序框图补充完整,则()A.①处为S=S+i,②处为i= 2020-11-01 …
算法框图如图所示,是求1~1000内所有偶数和,则空格处应填()A.①s=s+i,②i=i+1B.① 2020-11-01 …
写出满足1×3×5×7×…×n>50000的最小正整数的算法.我是这样写的:S1:令S=1.S2:令 2020-11-01 …
请设计程序框图求S=1^2-2^2+3^2-4^2+…+(n-1)^2-n^2的值,要求输入n,输出 2021-01-15 …