早教吧作业答案频道 -->化学-->
硼及其化合物在工农业生产中应用广泛.已知:硼镁矿的主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程为回答下列有关问题:(1)硼砂中B的
题目详情
硼及其化合物在工农业生产中应用广泛.已知:硼镁矿的主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程为
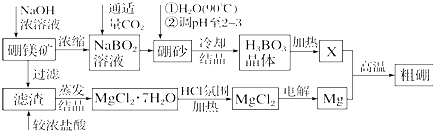
回答下列有关问题:
(1)硼砂中B的化合价为___价;溶于热水后,常用稀硫酸调pH至2~3制取H3BO3,该反应的离子方程式为___.
X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为___.
(2)MgCl2•7H2O在HCl氛围中加热的原因是___.
若用惰性电极电解MgCl2溶液,其阴极反应式为___.
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,则其正极反应式为___.常温下,若起始电解质溶液pH=1,则pH=2时,溶液中Mg2+的浓度为___.已知Ksp[Mg(OH)2]=5.610-12,当溶液pH=6时,___(填“有”或“没有”)Mg(OH)2沉淀析出.
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼.现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol•L-1Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL.该粗硼样品的纯度为___.(提示:I2+2S2O32-═2I-+S4O62-)

回答下列有关问题:
(1)硼砂中B的化合价为___价;溶于热水后,常用稀硫酸调pH至2~3制取H3BO3,该反应的离子方程式为___.
X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为___.
(2)MgCl2•7H2O在HCl氛围中加热的原因是___.
若用惰性电极电解MgCl2溶液,其阴极反应式为___.
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,则其正极反应式为___.常温下,若起始电解质溶液pH=1,则pH=2时,溶液中Mg2+的浓度为___.已知Ksp[Mg(OH)2]=5.610-12,当溶液pH=6时,___(填“有”或“没有”)Mg(OH)2沉淀析出.
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼.现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol•L-1Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL.该粗硼样品的纯度为___.(提示:I2+2S2O32-═2I-+S4O62-)
▼优质解答
答案和解析
(1)硼砂的化学式为Na2B4O7•10H2O,钠元素化合价为+1价,氧元素化合价-2价,依据化合价代数和计算得到硼元素化合价为+3价;用H2SO4调pH2~3,硼砂中的Na2B4O7在酸溶液中生成H3BO3 ,反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3,X为H3BO3晶体加热脱水的产物是B2O3,镁和得到B2O3反应生成氧化镁和硼,反应的化学方程式为:3Mg+B2O3
2B+3MgO,反应中元素化合价降低的做氧化剂,硼元素化合价+3价变化为0价,则B2O3做氧化剂;
故答案为:+3;B4O72-+2H++5H2O=4H3BO3;3Mg+B2O3
2B+3MgO;
(2)MgCl2•7H2O需要在HCl氛围中加热,是为了防止氯化镁水解生成氢氧化镁;若用惰性电极电解MgCl2溶液,阴极氢离子得到电子生成氢气,水的电离平衡破坏,水电离生成氢氧根离子浓度增大,和镁离子形成氢氧化镁沉淀,合并写出阴极反应式为:2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
故答案为:防止MgCl2水解生成Mg(OH)2;2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,正极上是过氧化氢得到电子生成水的反应,正极反应式H2O2+2H++2e-=2H2O;若起始电解质溶液pH=1,则pH=2时溶液中,氢离子浓度减小0.1mol/L-0.01mol/L=0.09mol/L,依据反应方程式得到Mg2+离子浓度=0.045mol/L;Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=6时,c(OH-)=10-8mol/L,则Qc=c(Mg2+)×c2(OH-)=0.045mol/L×10-16mol/L=4.5×10-18<Ksp[Mg(OH)2],说明无氢氧化镁沉淀生成;
故答案为:H2O2+2H++2e-=2H2O;0.045 mol•L-1;没有;
(4)硫代硫酸钠的物质的量为:0.30mol/L×0.018L=0.0054mol,I2+2S2O32-=2I-+S4O62-,
根据关系式:B~BI3~
I2~3S2O32-,
n(B)=
n(S2O32-)=0.0018mol,
硼的质量为:10.8g/mol×0.0018mol=0.01944g,粗硼中硼的含量为:
×100%=97.2%,
故答案为:97.2%.
| ||
故答案为:+3;B4O72-+2H++5H2O=4H3BO3;3Mg+B2O3
| ||
(2)MgCl2•7H2O需要在HCl氛围中加热,是为了防止氯化镁水解生成氢氧化镁;若用惰性电极电解MgCl2溶液,阴极氢离子得到电子生成氢气,水的电离平衡破坏,水电离生成氢氧根离子浓度增大,和镁离子形成氢氧化镁沉淀,合并写出阴极反应式为:2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
故答案为:防止MgCl2水解生成Mg(OH)2;2H2O+Mg2++2e-=H2↑+Mg(OH)2↓;
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,正极上是过氧化氢得到电子生成水的反应,正极反应式H2O2+2H++2e-=2H2O;若起始电解质溶液pH=1,则pH=2时溶液中,氢离子浓度减小0.1mol/L-0.01mol/L=0.09mol/L,依据反应方程式得到Mg2+离子浓度=0.045mol/L;Ksp[Mg(OH)2]=5.6×10-12,当溶液pH=6时,c(OH-)=10-8mol/L,则Qc=c(Mg2+)×c2(OH-)=0.045mol/L×10-16mol/L=4.5×10-18<Ksp[Mg(OH)2],说明无氢氧化镁沉淀生成;
故答案为:H2O2+2H++2e-=2H2O;0.045 mol•L-1;没有;
(4)硫代硫酸钠的物质的量为:0.30mol/L×0.018L=0.0054mol,I2+2S2O32-=2I-+S4O62-,
根据关系式:B~BI3~
| 3 |
| 2 |
n(B)=
| 1 |
| 3 |
硼的质量为:10.8g/mol×0.0018mol=0.01944g,粗硼中硼的含量为:
| 0.01944g |
| 0.0200g |
故答案为:97.2%.
看了 硼及其化合物在工农业生产中应...的网友还看了以下:
想来个主动作为意识不强的成语,主动作为什么好呢? 2020-04-11 …
粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示:回答下列问题: 2020-05-12 …
下列有关生物膜的叙述错误的是()A.生物膜的成分主要是脂质和蛋白质,其功能主要取决于蛋白质的种类和 2020-05-14 …
“蚁穴溃堤”的成语主要解释了生物对环境造成的影响.( )燃烧化石燃料产生的二氧化硫是氮氧化物是造成 2020-05-16 …
在简历和自我介绍上试用的成语?主要是希望能通过成语做一个点缀和总结.最后希望能传达一个信息给HR, 2020-05-17 …
第一次世界大战爆发前组成协约国的成员主要是[]A.英、法、美B.英、法、德C.英、法、俄D.德、意 2020-06-17 …
市场出售的“热敷袋”其中的成分主要是铁粉、碳粉、浸氧多孔木屑和少量氯化钠、水等。热敷袋用塑料袋密封 2020-06-21 …
读“昆明准静止锋示意图”,完成18~19题.据图分析昆明准静止锋的成因主要是:()A.暖气团势力强 2020-06-26 …
雨水脏不脏?雨水的成分主要是水(化学成份H2O),有少量二氧化硫,二氧化氮,会形成酸雨,如遇雷雨, 2020-07-04 …
牛顿是近代自然科学的奠基人之一,他的成就主要体现在天文学、数学、力学方面.其中,在天文学上的主要贡 2020-07-06 …