早教吧作业答案频道 -->化学-->
氮化硼(BN)是重要的功能材料,常用作陶瓷、涂料等,请回答下列问题:(1)写出基态B原子的核外电子排布式,基态N原子中未成对电子数为.(2)电负性BN(填“大于”或“小于
题目详情
氮化硼(BN)是重要的功能材料,常用作陶瓷、涂料等,请回答下列问题:
(1)写出基态B原子的核外电子排布式___,基态N原子中未成对电子数为___.
(2)电负性B___N(填“大于”或“小于”).
(3)BF3中B的杂化轨道类型为___,NCl3分子的立体构型为___.
(4)高纯BF3可由NaBF4(四氟硼酸钠)热分解制得,BF4-键角比NCl3的键角更大的原因是___.NaBF4晶体中各微粒间的作用力不涉及___(填字母序号).
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(5)一种BN的晶胞结构如图所示: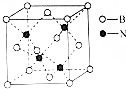
该晶体熔点可达3000℃,则其晶体类型为___,N的配位数为___,该晶胞边长为361.5pm,则其密度是___g•cm-1(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
(1)写出基态B原子的核外电子排布式___,基态N原子中未成对电子数为___.
(2)电负性B___N(填“大于”或“小于”).
(3)BF3中B的杂化轨道类型为___,NCl3分子的立体构型为___.
(4)高纯BF3可由NaBF4(四氟硼酸钠)热分解制得,BF4-键角比NCl3的键角更大的原因是___.NaBF4晶体中各微粒间的作用力不涉及___(填字母序号).
a.离子键 b.共价键 c.配位键 d.氢键 e.范德华力
(5)一种BN的晶胞结构如图所示:

该晶体熔点可达3000℃,则其晶体类型为___,N的配位数为___,该晶胞边长为361.5pm,则其密度是___g•cm-1(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA).
▼优质解答
答案和解析
(1)基态B原子的核外有5个电子,根据构造原理书写基态B原子核外电子排布式为1s22s22p1;基态N原子核外电子排布式为1s22s22p3,该原子中未成对电子数为3,
故答案为:1s22s22p1;3;
(2)同一周期元素,所以的电负性随着原子序数增大而增大,B、N位于同一周期且原子序数B(3)BF3中B价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知,该分子中B原子采用sp2杂化;NCl3分子中N原子价层电子对个数是4且含有一个孤电子对,其空间构型是三角锥形,
故答案为:sp2;三角锥形;
(4)孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,BF4-中成键电子对之间的排斥力小于NCl3中孤电子对和成键电子对之间的排斥力,导致BF4-键角比NCl3的键角大;
NaBF4晶体中含有离子键、共价键、配位键,
故答案为:BF4-中成键电子对之间的排斥力小于NCl3中孤电子对和成键电子对之间的排斥力;abc;
(5)原子晶体熔沸点较高,则为原子晶体;N原子配位数为4,该晶胞中N原子个数为4、B原子个数=8×
+6×
=4,该晶体密度=
=
g•cm-1,
故答案为:原子晶体;4;
.
故答案为:1s22s22p1;3;
(2)同一周期元素,所以的电负性随着原子序数增大而增大,B、N位于同一周期且原子序数B
故答案为:sp2;三角锥形;
(4)孤电子对与成键电子对之间的排斥力大于成键电子对之间的排斥力,BF4-中成键电子对之间的排斥力小于NCl3中孤电子对和成键电子对之间的排斥力,导致BF4-键角比NCl3的键角大;
NaBF4晶体中含有离子键、共价键、配位键,
故答案为:BF4-中成键电子对之间的排斥力小于NCl3中孤电子对和成键电子对之间的排斥力;abc;
(5)原子晶体熔沸点较高,则为原子晶体;N原子配位数为4,该晶胞中N原子个数为4、B原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
| ||
| V |
| ||
| (3.615×10-8)3 |
故答案为:原子晶体;4;
| ||
| (3.615×10-8)3 |
看了 氮化硼(BN)是重要的功能材...的网友还看了以下:
A市在B市的12km的位置,给B市发货的车以40km/时送货,以60km/时返回A市,往返1时10 2020-04-27 …
小学动手动脑题小玲要用一块长70厘米,宽9厘米的布头做一个打口袋的沙袋.要求这个沙袋的每个面都是正 2020-05-12 …
小明暑假随父母到“新马泰”旅游,获得了以下两点深刻的感受:①东南亚的城市大多分布在河流沿岸;②有的 2020-05-13 …
物质的性质决定了物质的用途.下列几种常见的物质的性质、用途不一致的是()A.金刚石硬度大--用于裁 2020-05-13 …
下图为某城市示意图。读图回答下列问题。(1)若图中工业区布局合理,则该地主导风向最有可能是。(2) 2020-05-15 …
汉武帝颁布的“推恩令”中对解决王国问题起决定作用的是()A.由嫡长子继承诸侯王的王位B.非 2020-05-16 …
化学问题(需要理由)一般的布料在100摄氏度的水里会分解出一些多人体有害的物质吗?就像磨豆腐时用布 2020-05-17 …
星罗棋布的村庄环抱着罗马,如蛛网般交叉的街道,一条条通往城市广场.用我看到的情景,用谚语概括 2020-05-20 …
题目在下方快,只限10分钟,快,急一块正方形的布剪去一个三角形;如果剪去三角形的面积与剩下的面积比 2020-05-23 …
据中国统计信息网2011年4月28公布的2010年中国第六次人口普查资料,截止2010年11月1日 2020-05-23 …