早教吧作业答案频道 -->化学-->
氟及其化合物的发现史充满艰辛,现在氟及其化合物在生产生活中被广泛使用,造福人类.(1)长期以来一直认为氟的含氧酸不存在,但是在1971年斯图杰尔和阿佩里曼成功地合成了次氟酸
题目详情
氟及其化合物的发现史充满艰辛,现在氟及其化合物在生产生活中被广泛使用,造福人类.
(1)长期以来一直认为氟的含氧酸不存在,但是在1971年斯图杰尔和阿佩里曼成功地合成了次氟酸后,这种论点被彻底动摇,他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸.
①写出次氟酸的电子式___
②次氟酸能被热水瞬间分解,生成一种常见的18e-物质M,该物质被称为“绿色氧化剂”,写出次氟酸与热水反应的化学方程式___
(2)氟单质极其活泼,化学家于1986年首次制得氟气,三步反应原理如下:
①___KMnO4+___H2O2+___KF+___HF=___K2MnF6+___O2↑+___H2O
②SbCl5+5HF═SbF5+5HCl
③2K2MnF6+4SbF5═4KSbF6+2MnF3+F2 (反应①、②里氟元素化合价不变)
则下列说法正确的是___
A.反应①配平后,氧化剂和还原剂的物质的量之比为3:2,
B.反应②③都是氧化还原反应
C.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用
D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个
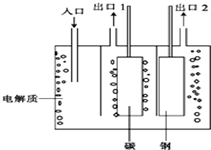
(3)工业上制备氟气通常采用电解氧化法,如图是电熔融的氟氢化钾(KHF2)和无水氟化氢的混合物的实验装置:
①已知阴极的电极反应式为2HF2-+2e-═H2↑+4F-,则电解的总反应为___
②出口1处的物质是___(填化学式),随着高温电解的进行,有一种物质会不断被挥发而消耗,需要从入口处进行补充,则从入口处加入的物质是___(填化学)
(4)巴特莱特制得第一个稀有气体化合物六氟合铂酸氙:Xe﹢PtF6﹦XePtF6,该化合物极易与水反应,生成氙、氧气和铂的+4价氧化物等,已知生成物氙和氧气的物质的量之比为2﹕1,试写出XePtF6与水反应的化学方程式___
(5)牙齿表面有一层釉质,其组成为羟基磷灰石Ca5(PO4)3OH(Ksp=6.8×10-37),容易受到酸的侵蚀,为了防止蛀牙,人们常使用含氟离子的牙膏,其中的氟化物可使羟基磷灰石转化为更难溶的氟磷灰石Ca5(PO4)3F(Ksp=1.0×10-60),写出该反应的离子方程式___;该反应的平衡常数为___.

(1)长期以来一直认为氟的含氧酸不存在,但是在1971年斯图杰尔和阿佩里曼成功地合成了次氟酸后,这种论点被彻底动摇,他们是在0℃以下将氟化物从细冰末的上面通过,得到毫克量的次氟酸.
①写出次氟酸的电子式___
②次氟酸能被热水瞬间分解,生成一种常见的18e-物质M,该物质被称为“绿色氧化剂”,写出次氟酸与热水反应的化学方程式___
(2)氟单质极其活泼,化学家于1986年首次制得氟气,三步反应原理如下:
①___KMnO4+___H2O2+___KF+___HF=___K2MnF6+___O2↑+___H2O
②SbCl5+5HF═SbF5+5HCl
③2K2MnF6+4SbF5═4KSbF6+2MnF3+F2 (反应①、②里氟元素化合价不变)
则下列说法正确的是___
A.反应①配平后,氧化剂和还原剂的物质的量之比为3:2,
B.反应②③都是氧化还原反应
C.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用
D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个
(3)工业上制备氟气通常采用电解氧化法,如图是电熔融的氟氢化钾(KHF2)和无水氟化氢的混合物的实验装置:
①已知阴极的电极反应式为2HF2-+2e-═H2↑+4F-,则电解的总反应为___
②出口1处的物质是___(填化学式),随着高温电解的进行,有一种物质会不断被挥发而消耗,需要从入口处进行补充,则从入口处加入的物质是___(填化学)
(4)巴特莱特制得第一个稀有气体化合物六氟合铂酸氙:Xe﹢PtF6﹦XePtF6,该化合物极易与水反应,生成氙、氧气和铂的+4价氧化物等,已知生成物氙和氧气的物质的量之比为2﹕1,试写出XePtF6与水反应的化学方程式___
(5)牙齿表面有一层釉质,其组成为羟基磷灰石Ca5(PO4)3OH(Ksp=6.8×10-37),容易受到酸的侵蚀,为了防止蛀牙,人们常使用含氟离子的牙膏,其中的氟化物可使羟基磷灰石转化为更难溶的氟磷灰石Ca5(PO4)3F(Ksp=1.0×10-60),写出该反应的离子方程式___;该反应的平衡常数为___.
▼优质解答
答案和解析
(1)①次氟酸HFO中O原子与H、F原子分别形成1对共用电子对,电子式为: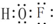 ,
,
故答案为: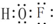 ;
;
②次氟酸能被热水瞬间分解,生成一种常见的18e-物质M,该物质被称为“绿色氧化剂”,则M为H2O2,反应还生成HF,反应方程式为:HOF+H2O=HF+H2O2 ,
故答案为:HOF+H2O=HF+H2O2 ;
(2)Mn元素化合价由KMnO4中+7价降低为K2MnF6中+4价,化合价共降低3价,H2O2中氧元素由-1价升高为O2中0价,化合价共升高2价,化合价升降最小公倍数为6,可知KMnO4、K2MnF6系数为2,H2O2、O2的系数为3,由原子守恒,配平后方程式为:2KMnO4+3H2O2+2KF+10HF=2K2MnF6+3O2↑+8H2O;
A.反应①中氧化剂是KMnO4,还原剂是H2O2,氧化剂和还原剂的物质的量之比为2:3,故A错误;
B.反应②中元素化合价均为发生变化,属于非氧化还原反应,故B错误;
C.反应③中K2MnF6中Mn元素化合价降低为MnF3中+3价,反应中F元素化合价由-1升高为0价,化合价变化的F元素可能来自K2MnF6中,故C正确;
D.反应①③属于氧化还原反应,反应②是非氧化还原反应,反应③中转移电子为0.5mol×2×1=1mol,由方程式可知需要K2MnF6的物质的量为0.5mol×2=1mol,由反应①中Mn元素化合价变化,可知反应①中转移电子为1mol×3=3mol,故整个过程转移电子为4NA,故D正确,
故答案为:2、3、2、10、2、2、8;CD;
(3)①阴极的电极反应式为2HF2-+2e-═H+4F-,阳极发生氧化反应,F-失去电子生成F2,整个过程生成H2、F2、KF,电解总反应式为 2KHF2
H2↑+F2↑+2KF,故答案为:2KHF2
H2↑+F2↑+2KF;
②钢电解应为阴极,碳为阳极,阳极生成气体为氟气,故出口1处的物质为F2,随着高温电解的进行,HF断被挥发而消耗,需要从入口处进行补充,故答案为:F2;HF;
(4)XePtF6与水反应生成Xe、PtO2、O2,氙和氧气的物质的量之比为2﹕1,假设物质的量分别为2mol、1mol,根据Xe原子守恒,可知XePtF6为2mol,由Pt原子守恒可知PtO2为2mol,由O原子守恒可知H2O为6mol,由H、F原子守恒可知还生成12mol HF,则反应方程式为:2XePtF6+6H2O=2Xe↑+2PtO2+12HF↑+O2↑,
故答案为:2XePtF6+6H2O=2Xe↑+2PtO2+12HF↑+O2↑;
(5)由题意可知,反应离子方程式为:Ca5(PO4)3OH+F-=Ca5(PO4)3F+OH-;该反应的平衡常数为=
=
=
=6.8×1023,
故答案为:Ca5(PO4)3OH+F-=Ca5(PO4)3F+OH-;6.8×1023.
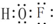 ,
,故答案为:
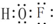 ;
;②次氟酸能被热水瞬间分解,生成一种常见的18e-物质M,该物质被称为“绿色氧化剂”,则M为H2O2,反应还生成HF,反应方程式为:HOF+H2O=HF+H2O2 ,
故答案为:HOF+H2O=HF+H2O2 ;
(2)Mn元素化合价由KMnO4中+7价降低为K2MnF6中+4价,化合价共降低3价,H2O2中氧元素由-1价升高为O2中0价,化合价共升高2价,化合价升降最小公倍数为6,可知KMnO4、K2MnF6系数为2,H2O2、O2的系数为3,由原子守恒,配平后方程式为:2KMnO4+3H2O2+2KF+10HF=2K2MnF6+3O2↑+8H2O;
A.反应①中氧化剂是KMnO4,还原剂是H2O2,氧化剂和还原剂的物质的量之比为2:3,故A错误;
B.反应②中元素化合价均为发生变化,属于非氧化还原反应,故B错误;
C.反应③中K2MnF6中Mn元素化合价降低为MnF3中+3价,反应中F元素化合价由-1升高为0价,化合价变化的F元素可能来自K2MnF6中,故C正确;
D.反应①③属于氧化还原反应,反应②是非氧化还原反应,反应③中转移电子为0.5mol×2×1=1mol,由方程式可知需要K2MnF6的物质的量为0.5mol×2=1mol,由反应①中Mn元素化合价变化,可知反应①中转移电子为1mol×3=3mol,故整个过程转移电子为4NA,故D正确,
故答案为:2、3、2、10、2、2、8;CD;
(3)①阴极的电极反应式为2HF2-+2e-═H+4F-,阳极发生氧化反应,F-失去电子生成F2,整个过程生成H2、F2、KF,电解总反应式为 2KHF2
| ||
| ||
②钢电解应为阴极,碳为阳极,阳极生成气体为氟气,故出口1处的物质为F2,随着高温电解的进行,HF断被挥发而消耗,需要从入口处进行补充,故答案为:F2;HF;
(4)XePtF6与水反应生成Xe、PtO2、O2,氙和氧气的物质的量之比为2﹕1,假设物质的量分别为2mol、1mol,根据Xe原子守恒,可知XePtF6为2mol,由Pt原子守恒可知PtO2为2mol,由O原子守恒可知H2O为6mol,由H、F原子守恒可知还生成12mol HF,则反应方程式为:2XePtF6+6H2O=2Xe↑+2PtO2+12HF↑+O2↑,
故答案为:2XePtF6+6H2O=2Xe↑+2PtO2+12HF↑+O2↑;
(5)由题意可知,反应离子方程式为:Ca5(PO4)3OH+F-=Ca5(PO4)3F+OH-;该反应的平衡常数为=
| c(OH-) |
| c(F-) |
| ||
|
| 6.8×10-37 |
| 1×10-60 |
故答案为:Ca5(PO4)3OH+F-=Ca5(PO4)3F+OH-;6.8×1023.
看了 氟及其化合物的发现史充满艰辛...的网友还看了以下:
定义时钟Clock类,满足以下要求:(1)有hour,minute,second私有成员变量。(2 2020-04-06 …
人类面对大自然,不甘于等待自然的恩赐,总想以自己有意识、有目的的生产劳动,利用自然、改造自然,以满 2020-06-02 …
如果化合物分为氧化物、酸类、碱类和盐类,那么氟化物呢?CH4呢?OF2是氧化物还是氟化物?根据定义 2020-06-04 …
请举例说明未来信息技术的发展趋势.求举例.(参考)1.信息技术辅人律,以满足人类需要为中心;2.信 2020-06-19 …
人类没有鸟儿的翅膀,却可以在天空中翱翔;人类没有鱼的腮鳍却可以在大海上遨游.这说明()A.人类无所 2020-07-05 …
硅或其氧化物为何能与氢氟酸反应(从微观解释)如题。老师说这是因为SiF4比较稳定且为气体,脱离反应 2020-07-06 …
氟酸和氢氟酸的区别,以及氟酸的物化性质! 2020-07-29 …
如图是氟元素在元素周期表中的相关息息以及氟元素的原子结构示意图.(1)氟元素的原子序数是;由氟原子 2020-07-29 …
目前绿色环保电冰箱采用了R600、R134a、环戊烷等制冷剂,作为氟利昂的替代品,充当热的“搬运工” 2020-11-05 …
用数学解决实际问题l类似满100送20连环送的数学问题某商店迎来店庆,为了吸引顾客,采取满100送2 2020-12-05 …