早教吧作业答案频道 -->化学-->
氟在自然界中常以CaF2的形式存在.(1)氟原子的价电子排布式为.HF能以任意比例溶于水,除了因为HF是极性分子外,还因为.(2)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为,其
题目详情
氟在自然界中常以CaF2的形式存在.
(1)氟原子的价电子排布式为___.HF能以任意比例溶于水,除了因为HF是极性分子外,还因为___.
(2)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___,其中氧原子的杂化方式为___.F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等.ClF3的沸点比BrF3的___ (填“高”或“低”).
(3)下列有关CaF2的表达正确的是___.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(4)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是___(用离子方程式表示). 已知AlF63-在溶液中可稳定存在.
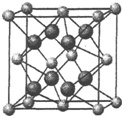
(5)CaF2晶胞结构如图,CaF2晶体中,F-的配位数是___,与一个Ca2+等距离且最近的Ca2+有___个.已知CaF2晶体密度为dg/cm3,则F-与F-的最短距离为___cm(用含d的代数式表示)

(1)氟原子的价电子排布式为___.HF能以任意比例溶于水,除了因为HF是极性分子外,还因为___.
(2)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为___,其中氧原子的杂化方式为___.F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等.ClF3的沸点比BrF3的___ (填“高”或“低”).
(3)下列有关CaF2的表达正确的是___.
a.Ca2+与F-间仅存在静电吸引作用
b.F-的离子半径小于Cl-,则CaF2的熔点高于CaCl2
c.阴阳离子比为2:1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(4)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是___(用离子方程式表示). 已知AlF63-在溶液中可稳定存在.
(5)CaF2晶胞结构如图,CaF2晶体中,F-的配位数是___,与一个Ca2+等距离且最近的Ca2+有___个.已知CaF2晶体密度为dg/cm3,则F-与F-的最短距离为___cm(用含d的代数式表示)
▼优质解答
答案和解析
(1)F的原子核有9个电子,分两层排布,最外层有7个电子,则F的价电子排布式为2s22p5;H2O与HF形成分子间氢键,二者互溶;
故答案为:2s22p5;H2O与HF形成分子间氢键;
(2)OF2分子中O原子的价层电子对数=2+
(6-2×1)=4,则O原子的杂化类型为sp3杂化,含有2个孤电子对,所以分子的空间构型为V形;卤素互化物的相对分子质量越大,其沸点越高,所以ClF3的沸点比BrF3的低;
故答案为:V形;sp3;低;
(3)a.阴阳离子间存在静电引力和静电斥力,Ca2+与F-间存在静电吸引作用,还存在静电斥力,故a错误;
b.离子晶体的熔点与离子所带电荷、离子半径有关,离子半径越小,离子晶体的熔点越高,所以CaF2的熔点高于CaCl2,故b正确;
c.晶体的结构与电荷比、半径比有关,阴阳离子比为2:1的物质,与CaF2晶体的电荷比相同,若半径比相差较大,则晶体构型不相同,故c错误;
d.CaF2中的化学键为离子键,离子化合物在熔融时能发生电离,存在自由移动的离子,能导电,因此CaF2在熔融状态下能导电,故b正确;
故答案为:bd;
(4)CaF2难溶于水,但可溶于含Al3+的溶液中,因为在溶液中F-与Al3+能形成很难电离的配离子AlF63-,使CaF2的溶解平衡正移,其反应的离子方程式为:3CaF2+Al3+=3Ca2++AlF63-;
故答案为:3CaF2+Al3+=3Ca2++AlF63-;
(5)CaF2晶体中与钙离子距离最近的氟离子有8个,所以其配位数为8;图中在每个晶胞中与Ca2+离子最近且等距离的Ca2+离子数为3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算2次,所以与Ca2+离子最近且等距离的Ca2+离子数为(8×3)÷2=12个;
晶胞中钙离子位于晶胞的8个顶点和6个面上,
×8+
×2=4,8个氟离子位于晶胞内部,则一个晶胞中含有4个CaF2,则晶胞的体积V=
,把晶胞均分为8个小立方体,则每个小立方体中含有一个氟离子,小立方体的体积为
×
=
,F-与F-的最短距离等于小立方体的棱长,则F-与F-的最短距离为
=
;
故答案为:4;12;
.
故答案为:2s22p5;H2O与HF形成分子间氢键;
(2)OF2分子中O原子的价层电子对数=2+
| 1 |
| 2 |
故答案为:V形;sp3;低;
(3)a.阴阳离子间存在静电引力和静电斥力,Ca2+与F-间存在静电吸引作用,还存在静电斥力,故a错误;
b.离子晶体的熔点与离子所带电荷、离子半径有关,离子半径越小,离子晶体的熔点越高,所以CaF2的熔点高于CaCl2,故b正确;
c.晶体的结构与电荷比、半径比有关,阴阳离子比为2:1的物质,与CaF2晶体的电荷比相同,若半径比相差较大,则晶体构型不相同,故c错误;
d.CaF2中的化学键为离子键,离子化合物在熔融时能发生电离,存在自由移动的离子,能导电,因此CaF2在熔融状态下能导电,故b正确;
故答案为:bd;
(4)CaF2难溶于水,但可溶于含Al3+的溶液中,因为在溶液中F-与Al3+能形成很难电离的配离子AlF63-,使CaF2的溶解平衡正移,其反应的离子方程式为:3CaF2+Al3+=3Ca2++AlF63-;
故答案为:3CaF2+Al3+=3Ca2++AlF63-;
(5)CaF2晶体中与钙离子距离最近的氟离子有8个,所以其配位数为8;图中在每个晶胞中与Ca2+离子最近且等距离的Ca2+离子数为3个,通过每个Ca2+可形成8个晶胞,每个Ca2+计算2次,所以与Ca2+离子最近且等距离的Ca2+离子数为(8×3)÷2=12个;
晶胞中钙离子位于晶胞的8个顶点和6个面上,
| 1 |
| 8 |
| 1 |
| 6 |
| ||
| ρ |
| ||
| ρ |
| 1 |
| 8 |
| 39 |
| ρNA |
| 3 |
| ||
| 3 |
| ||
故答案为:4;12;
| 3 |
| ||
看了 氟在自然界中常以CaF2的形...的网友还看了以下:
辨析下列句子中虚词的不同用法以:1、以头抢地耳2、而君以五十里之地存者3、徒以有先生也于:1、受地于 2020-03-30 …
求解高中数学已知椭圆:(x的平方除以4)加上(y的平方除以3)等于1,A,.B为椭圆上的左右顶点, 2020-04-12 …
1、如果a是b的1/3,那么b就是a的3倍.以下都是判断题2、两个分数相除,商一定小于被除数.3、 2020-05-14 …
小明学习了(等式的性质)后对小亮说我发现3可以等于2,你看这里有一个方程3x减2等于2x减2,等式 2020-05-16 …
船舶名词:位置1和位置2位置1:是指在露天干舷甲板和后升高甲板上,以及位于从首垂线起船长的四分之一 2020-06-06 …
一个不为0的数除以1/5的商,比这个数乘以1/5的积大还是小?为什么4又1/2÷3=4又1/2-3 2020-06-10 …
一词多义以1.于是乘其厉声以呵2.中丞匿于溷藩以免3.既而已吴民之乱请于朝4.卒以吴郡之发愤一击5 2020-06-12 …
若关于x的方程x+2/x=c+2/c的解是x1=c,x2=2/c,则关于x的方程x+2/(x-1) 2020-06-27 …
一共有3到都是关于等比数列的1.已知a1乘以a3等于9.a3乘以a6等于18求a172.已知a5减 2020-07-18 …
给出下列四个说法:①由于0.3,0.4,0.5不是勾股数,所以以0.3,0.4,0.5为边长的三角 2020-07-26 …