硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:(1)硅主要以硅酸盐、等化合物的形式存在于地壳中。(2)单质硅存在与金刚石结构类似
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1) 硅主要以硅酸盐、 ____________ 等化合物的形式存在于地壳中。
(2) 单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 ________ 相结合,其晶胞中共有 8 个原子,其中在面心位置贡献 ________ 个原子。
(3) 单质硅可通过甲硅烷 (SiH 4 ) 分解反应来制备。工业上采用 Mg 2 Si 和 NH 4 Cl 在液氨介质中反应制得 SiH 4 ,该反应的化学方程式为 ______________________________________ 。
(4) 碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C—C | C—H | C—O | Si—Si | Si—H | Si—O |
| 键能 / (kJ·mol - 1 ) | 356 | 413 | 336 | 226 | 318 | 452 |
① 硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 ________________________________________________________________________ 。
②SiH 4 的稳定性小于 CH 4 ,更易生成氧化物,原因是 ________________________________
________________________________________________________________________ 。
(5) 在硅酸盐中, SiO ![]() 四面体 [ 如下图 (a)] 通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图 (b) 为一种无限长单链结构的多硅酸根,其中 Si 原子的杂化形式为 __________ , Si 与 O 的原子数之比为 __________ ,化学式为 __________ 。
四面体 [ 如下图 (a)] 通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图 (b) 为一种无限长单链结构的多硅酸根,其中 Si 原子的杂化形式为 __________ , Si 与 O 的原子数之比为 __________ ,化学式为 __________ 。
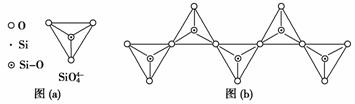
解析 (1) 硅在自然界中主要以硅酸盐和二氧化硅等化合物的形式存在于地壳中。
(2) 单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以硅硅共价键相结合,其晶胞中共有 8 个原子,其中在面心位置的是 6 个原子,每个面心原子贡献二分之一,所以 6 个面心原子对该晶胞贡献 3 个原子。
(3) 根据题意:工业上采用 Mg 2 Si 和 NH 4 Cl 在液氨介质中反应制得 SiH 4 ,该反应的化学方程式为 Mg 2 Si + 4NH 4 Cl == =SiH 4 + 4NH 3 + 2MgCl 2 。
(4)① 分析表格中 C—C 键、 C—H 键、 Si—Si 键、 Si—H 键的键能,可以得出: C—C 键和 C—H 键较强,所形成的烷烃稳定,而硅烷中 Si—Si 键和 Si—H 键的键能较低,易断裂,导致长链硅烷难以生成,所以硅烷在种类和数量上都远不如烷烃多; ② 分析表格中 C—H 键、 C—O 键、 Si—H 键、 Si—O 键的键能,可以得出: C—H 键的键能大于 C—O 键, C—H 键比 C—O 键稳定,而 Si—H 键的键能却远小于 Si—O 键,所以 Si—H 键不稳定而倾向于形成稳定性更强的 Si—O 键,所以 SiH 4 的稳定性小于 CH 4 ,更易生成氧化物。
(5) 图 (b) 为一种无限长单链结构的多硅酸根,其中每个 Si 原子和 4 个氧原子形成四面体结构,故 Si 原子杂化方式为 sp 3 , Si 与 O 原子数之比为 1∶3 ,化学式为 [SiO 3 ] ![]() ( 或 SiO
( 或 SiO ![]() ) 。
) 。
答案 (1) 二氧化硅 (2) 共价键 3 (3)Mg 2 Si + 4NH 4 Cl == =SiH 4 + 4NH 3 + 2MgCl 2 (4)①C—C 键和 C—H 键较强,所形成的烷烃稳定。而硅烷中 Si—Si 键和 Si—H 键的键能较低,易断裂。导致长链硅烷难以生成 ②C—H 键的键能大于 C—O 键, C 一 H 键比 C—O 键稳定。而 Si—H 键的键能却远小于 Si—O 键,所以 Si—H 键不稳定而倾向于形成稳定性更强的 Si—O 键 (5)sp 3 1∶3 [SiO 3 ] ![]() ( 或 SiO
( 或 SiO ![]() )
)
填空题:按是不是2的倍数可以把整数分成{}和{}两类,按因数的多少把非零自然数分成{}、{}和{} 2020-04-09 …
python中,输出1000-10000之间的数,分为4类,存入不同的数组第一类是4位都相同同的数 2020-04-27 …
世界各国的园林大致可分为两大类:一类是2( )世纪以前的欧洲几何规则式园林;另类是中国 2020-05-20 …
0258组成三位数,还要是奇数什么的,要写好分类哦,好的话给高分0258组成奇数偶数2的倍数5的倍 2020-06-13 …
为了探究一种新型碱性纤维素酶的去污效能,研究性学习小组进行了相关实验,结果如图.由图中实验结果能直 2020-06-16 …
把五个信封投入三个邮筒,每个邮筒至少投一封信,则不同投注共有多少种投法?要有详细的分析和解题过程. 2020-06-24 …
1/1,2/1,1/2,3/1,2/2,1/3,4/1,3/2,2/3,1/4,5/1,4/2,3 2020-07-02 …
1/2+1/22+1/23+1/24+……+1/210=?请大家告诉我一个巧妙的做法第二个数不是2 2020-07-09 …
A类网络个数是多少?求A类网络个数,由于其网络号是8,但最高位必须为0,因此可表示多少个网络?(我 2020-07-14 …
(提示:2^1就是2的一次方,依次类推)2^1-2^0=1=2^0,2^2-2^1=2=2^1.按 2020-07-16 …