早教吧作业答案频道 -->化学-->
研究硫元素及其化合物的性质具有重要意义.Ⅰ.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:(熔点:SO2-76.1℃,SO316.8℃;沸点:SO2-10℃,SO345℃)(1)甲同学按I
题目详情
研究硫元素及其化合物的性质具有重要意义.
Ⅰ.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 45℃)
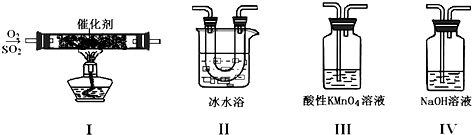
(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是___;装置III中溶液逐渐褪色,证明二氧化硫具有___性.
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40mL 3.0mol/L NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是___.
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成.向该试管中加入足量___(填字母),便能产生沉淀.
A.硫化钠溶液 B.氨水 C.盐酸 D.硝酸钾溶液
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
(4)甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+应选用___(选填序号).
a.KSCN溶液和氯水 b.氢氧化钠溶液
c.酸性KMnO4溶液 d.铁粉和KSCN溶液
(5)乙同学取784mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g.由此推知气体Y中SO2的体积百分数为___.(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和C02气体,产生C02的理由是___(用化学方程式表示).
Ⅰ.利用下图装置模拟工业生产中SO2催化氧化的反应并研究SO2的性质:
(熔点:SO2-76.1℃,SO3 16.8℃;沸点:SO2-10℃,SO3 45℃)

(1)甲同学按I、II、III、IV的顺序连接装置,装置II的作用是___;装置III中溶液逐渐褪色,证明二氧化硫具有___性.
(2)乙同学按Ⅰ、Ⅱ、Ⅳ的顺序连接装置(装置Ⅱ中充分冷却),若装置Ⅳ中有40mL 3.0mol/L NaOH溶液,反应后增重5.12g,则装置Ⅳ中发生反应的化学方程式是___.
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管中,未见沉淀生成.向该试管中加入足量___(填字母),便能产生沉淀.
A.硫化钠溶液 B.氨水 C.盐酸 D.硝酸钾溶液
Ⅱ.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
称取铁钉(碳素钢)6g放入15mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y.
(4)甲同学认为X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+应选用___(选填序号).
a.KSCN溶液和氯水 b.氢氧化钠溶液
c.酸性KMnO4溶液 d.铁粉和KSCN溶液
(5)乙同学取784mL(标准状况)气体Y通入足量H2O2水溶液中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g.由此推知气体Y中SO2的体积百分数为___.(保留小数点后一位)
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和C02气体,产生C02的理由是___(用化学方程式表示).
▼优质解答
答案和解析
(1)装置II的作用是冷却装置,三氧化硫的沸点较低,通过冰水混合物,使SO3凝结成固体与SO2分离,装置III中高锰酸钾溶液会和二氧化硫反应逐渐褪色,生成Mn2+,二氧化硫被氧化为硫酸,表现了二氧化硫的还原性,反应的离子方程式为:5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+,
故答案为:使SO3凝结成固体与SO2分离,还原性;
(2)若装置IV中有40mL 3mol•L-1NaOH溶液,反应后增重5.12g,吸收的为二氧化硫气体,依据二氧化硫物质的量和氢氧化钠物质的量进行分析判断生成产物,若n(SO2):n(NaOH)=1:2反应按照反应:SO2+2NaOH=Na2SO3+H2O;若n(SO2):n(NaOH)=1:1,反应按照反应SO2+NaOH=NaHSO3;装置IV中有40mL 3mol•L-1NaOH溶液中n(NaOH)=0.12mol,n(SO2)=
=0.08mol;n(SO2):n(NaOH)=0.08:0.12=2:3,所以生成产物为亚硫酸钠和亚硫酸氢钠,反应的化学方程式依据直平法写出:2SO2+3NaOH═Na2SO3+NaHSO3+H2O,
故答案为:2SO2+3NaOH=Na2SO3+NaHSO3+H2O;
(3)A.加入硫化钠溶液,二氧化硫和硫化钠反应生成硫单质沉淀,故A正确;
B.在试管里加入氨水后,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与氯化钡可生成亚硫酸钡白色沉淀,故B正确;
C.足量的SO2通入装有氯化钡溶液的试管,再加稀盐酸无沉淀产生,故C错误;
D.足量的SO2通入装有氯化钡溶液的试管,溶液呈酸性,硝酸钾中的硝酸根离子在酸性条件下,有强氧化性,可以将SO2氧化成硫酸根,再与氯化钡产生硫酸钡白色沉淀,故D正确;
故答案为:ABD;
(4)+2价亚铁离子能使酸化的高锰酸钾褪色,a、d都不能检验亚铁离子,只有C能检验溶液中含有+2价铁离子,选b会生成两种沉淀,受氢氧化铁颜色的影响无法辨别,只能选C,
故答案为:C;
(5)SO2具有还原性,通入足量过氧化氢中发生反应:SO2+2H2O2=2H2O+H2SO4,
标况下784mL混合气体的物质的量为:n(混合气体)=
=0.035mol,
SO2→BaSO4
1mol 233g
n 4.66g
则:n=
=0.02mol,
故混合气体中SO2的体积分数为:
×100%≈57.1%,
故答案为:57.1%;
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和C02气体,产生C02的理由是产生C02的理由是碳和浓硫酸加热反应生成二氧化碳和二氧化硫,反应的化学方程式为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;
故答案为:使SO3凝结成固体与SO2分离,还原性;
(2)若装置IV中有40mL 3mol•L-1NaOH溶液,反应后增重5.12g,吸收的为二氧化硫气体,依据二氧化硫物质的量和氢氧化钠物质的量进行分析判断生成产物,若n(SO2):n(NaOH)=1:2反应按照反应:SO2+2NaOH=Na2SO3+H2O;若n(SO2):n(NaOH)=1:1,反应按照反应SO2+NaOH=NaHSO3;装置IV中有40mL 3mol•L-1NaOH溶液中n(NaOH)=0.12mol,n(SO2)=
| 5.12g |
| 64g/mol |
故答案为:2SO2+3NaOH=Na2SO3+NaHSO3+H2O;
(3)A.加入硫化钠溶液,二氧化硫和硫化钠反应生成硫单质沉淀,故A正确;
B.在试管里加入氨水后,二氧化硫与氨水反应生成亚硫酸铵,亚硫酸铵与氯化钡可生成亚硫酸钡白色沉淀,故B正确;
C.足量的SO2通入装有氯化钡溶液的试管,再加稀盐酸无沉淀产生,故C错误;
D.足量的SO2通入装有氯化钡溶液的试管,溶液呈酸性,硝酸钾中的硝酸根离子在酸性条件下,有强氧化性,可以将SO2氧化成硫酸根,再与氯化钡产生硫酸钡白色沉淀,故D正确;
故答案为:ABD;
(4)+2价亚铁离子能使酸化的高锰酸钾褪色,a、d都不能检验亚铁离子,只有C能检验溶液中含有+2价铁离子,选b会生成两种沉淀,受氢氧化铁颜色的影响无法辨别,只能选C,
故答案为:C;
(5)SO2具有还原性,通入足量过氧化氢中发生反应:SO2+2H2O2=2H2O+H2SO4,
标况下784mL混合气体的物质的量为:n(混合气体)=
| 0.784L |
| 22.4mol/L |
SO2→BaSO4
1mol 233g
n 4.66g
则:n=
| 1mol×4.66g |
| 233g/mol |
故混合气体中SO2的体积分数为:
| 0.02mol |
| 0.035mol |
故答案为:57.1%;
(6)分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和C02气体,产生C02的理由是产生C02的理由是碳和浓硫酸加热反应生成二氧化碳和二氧化硫,反应的化学方程式为:C+2H2SO4(浓)
| ||
故答案为:C+2H2SO4(浓)
| ||
看了 研究硫元素及其化合物的性质具...的网友还看了以下:
组态王IF语句请解释if(加小产==1){加产量1=产量-19;if(加产量1==0.8){控制2 2020-05-13 …
(1)一个数的1点5倍是3点1与0点5的和的6倍,这个数是多少?(列式计算)(2)新城水泥厂今年三 2020-06-03 …
管理学原理计算题某公司投资生产某产品,形成产能40万件/年,固定成本400万元,单位变动成本为60 2020-06-15 …
读我国十大重点产业集聚区示意图,回答下列问题。(1)简述我国十大重点产业集聚区的分布特点。(2)简 2020-06-15 …
计算题某企业生产某种产品,销售单价为500元,单位产品变动费用为200元,年产销达到6000件时实 2020-06-26 …
电解水实验:(1)负极产生的是,正极产生的是,负极产生的气体与正极产生的气体的体积比为,质量比为; 2020-07-16 …
已知某厂生产某种产品100件,单位售价400元,固定成本12000,总变动成本24000求保本点产 2020-07-16 …
某企业生产产品,产品单位可变费用5元,单价12元,每年固定费用7万元(1)预测该企业盈亏平衡点产量 2020-07-30 …
某企业决定生产一批产品.基建与机器设备投资等总固定成本为60000元,单位产品售价3元,单位变动成本 2020-11-21 …
(1)一个数的1点5倍是3点1与0点5的和的6倍,这个数是多少?(列式计算)(2)新城水泥厂今年三( 2020-12-05 …