早教吧作业答案频道 -->化学-->
第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:(1)在元素周期表中N、O、F三种元素
题目详情
第VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,含第VIA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
(1)在元素周期表中N、O、F三种元素相邻,这三种元素的第一电离能由小到大的顺序是___.
(2)氧元素的存在影响了很多物质的性质,乙醇(CH3CH2OH)和二甲醚(CH3OCH3)的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是___.
(3)Se元素基态原子的价电子排布式为___.CSe2首次是由H2Se与CCl4反应后制取的.CSe2分子内的Se-C-Se键角___(填“大于”“等于”或“小于”)H2Se分子内的H-Se-H键角.
(4)根据价电子对互斥理论,可以推知SO2分子的空间构型为___,其中S原子采用的轨道杂化形式为___.
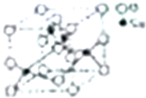
(5)铜与氧能形成CuO和Cu2O两种氧化物,某种铜的氧化物的结构如图所示.
①该氧化物的化学式为___.
②该晶体中氧原子的配位数为___.晶体中距离最近的4个铜原子构成的几何形状为___.

(1)在元素周期表中N、O、F三种元素相邻,这三种元素的第一电离能由小到大的顺序是___.
(2)氧元素的存在影响了很多物质的性质,乙醇(CH3CH2OH)和二甲醚(CH3OCH3)的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是___.
(3)Se元素基态原子的价电子排布式为___.CSe2首次是由H2Se与CCl4反应后制取的.CSe2分子内的Se-C-Se键角___(填“大于”“等于”或“小于”)H2Se分子内的H-Se-H键角.
(4)根据价电子对互斥理论,可以推知SO2分子的空间构型为___,其中S原子采用的轨道杂化形式为___.
(5)铜与氧能形成CuO和Cu2O两种氧化物,某种铜的氧化物的结构如图所示.
①该氧化物的化学式为___.
②该晶体中氧原子的配位数为___.晶体中距离最近的4个铜原子构成的几何形状为___.
▼优质解答
答案和解析
(1)同周期元素自左而右,第一电离能呈增大趋势,但是氮原子2p能级有3个电子,处于半满稳定状态,电子能量降低,所以第一电离能高于同周期相邻元素的第一电离能,所以三者的第一电离能由小到大的顺序为:O故答案为:O(2)CH3CH2OH含氢键,使其沸点升高,CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是乙醇分子之间形成氢键,故答案为:乙醇分子之间形成氢键;
(3)硒是34号元素,基态原子核外有34个电子,其基态原子核外电子排布式为:1s22s22p63s23p63d104s24p4;CSe2与CO2结构相似,二氧化碳是直线型分子,H2Se分子为v型分子,所以CSe2分子内的Se-C-Se键角大于H2Se分子内的H-Se-H键角,
故答案为:1s22s22p63s23p63d104s24p4;大于;
(4)二氧化硫分子中,中心原子S形成两个2个σ键、含有1对孤对电子,故杂化轨道数为3,采取sp2杂化,其空间结构为V形,
故答案为:V形;sp2;
(5)①在晶胞结构中,黑颜色球代表的Cu位于体内,共4个;白颜色球代表的O有8个位于顶点、6个位于面心,晶胞中总个数为:8×
+6×
=4,化学式可写为CuO,
故答案为:CuO;
②氧化铜晶胞的体心的氧离子周围包围了4个铜离子,则其配位数为4;由于晶体中距离最近的4个铜原子与体心的氧原子距离完全相同,所以这四个Cu原子构成了正四面体结构,
故答案为:4;正四面体.
(3)硒是34号元素,基态原子核外有34个电子,其基态原子核外电子排布式为:1s22s22p63s23p63d104s24p4;CSe2与CO2结构相似,二氧化碳是直线型分子,H2Se分子为v型分子,所以CSe2分子内的Se-C-Se键角大于H2Se分子内的H-Se-H键角,
故答案为:1s22s22p63s23p63d104s24p4;大于;
(4)二氧化硫分子中,中心原子S形成两个2个σ键、含有1对孤对电子,故杂化轨道数为3,采取sp2杂化,其空间结构为V形,
故答案为:V形;sp2;
(5)①在晶胞结构中,黑颜色球代表的Cu位于体内,共4个;白颜色球代表的O有8个位于顶点、6个位于面心,晶胞中总个数为:8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:CuO;
②氧化铜晶胞的体心的氧离子周围包围了4个铜离子,则其配位数为4;由于晶体中距离最近的4个铜原子与体心的氧原子距离完全相同,所以这四个Cu原子构成了正四面体结构,
故答案为:4;正四面体.
看了 第VIA族的氧、硫、硒(Se...的网友还看了以下:
读图和表,回答问题。表4重要矿产品价格变化矿产品名称单位2001年2010年原煤元/吨245723 2020-04-06 …
老王打的回家,三千米内起步价10元,三至五千米内1.8元,五千米以后每千米2.7元,回到家恰好要付 2020-04-11 …
小明买售价1.4元的圆珠笔一支,根据你的生活经验,结合人民币币值特点,下列付钱方法不合理的是()A 2020-05-13 …
设集合A的元素都是正整数,满足如下条件: ①A的元素个数不小于三; ②若a∈A,则a的所有正因数都 2020-05-17 …
若规定:信件重200克及以内的,每20克(不足20克的按20克计算)本埠0,80元,外埠1,20元 2020-05-20 …
我问大家一个问题:我有1.5元,盐1.5元一斤,火柴2分一盒,请问我为什么买了一斤盐还买了一盒火柴 2020-06-07 …
小明有8元钱,他准备用这钱买某种饮料喝.饮料公司为收回旧饮料瓶保护环境,规定有3个饮料瓶可以换回1 2020-06-26 …
A花8元买只鸡以9元卖出,因后悔花10元买回以11元卖出,问A赚了多少?A.赚1元B.赚2元C.赚 2020-06-26 …
根据下面的银行报价回答问题:美元/日元103.4/103.7,英镑/美元1.3040/1.3050请 2020-11-05 …
某厂生产某种产品x(百台)总成本为f(x)(万元)其中固定成本为2万元每生产1百台成本增加1万元10 2020-11-05 …