早教吧作业答案频道 -->化学-->
为了测定某赤铁矿中氧化铁(Fe2O3)的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应).方案1取8.00g赤铁矿粉,加入足量稀硫
题目详情
为了测定某赤铁矿中氧化铁(Fe2O3)的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应).
【方案1】取8.00g赤铁矿粉,加入足量稀硫酸,完全反应后过滤,得到1.60g滤渣.则赤铁矿粉中氧化铁的质量分数为___.
【方案2】如图所示,取8.00g赤铁矿粉与足量的焦炭粉混合加强热,充分反应.测得NaOH溶液(用于吸收二氧化碳)反应前后质量增加了1.32g.根据反应3C+2Fe2O3
4Fe+3CO2↑计算该方案得出的赤铁矿粉中氧化铁的质量分数.
【实验反思】你认为哪种方案测得的结果更准确?___,请简述理由.___.
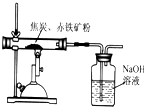
【方案1】取8.00g赤铁矿粉,加入足量稀硫酸,完全反应后过滤,得到1.60g滤渣.则赤铁矿粉中氧化铁的质量分数为___.
【方案2】如图所示,取8.00g赤铁矿粉与足量的焦炭粉混合加强热,充分反应.测得NaOH溶液(用于吸收二氧化碳)反应前后质量增加了1.32g.根据反应3C+2Fe2O3
| ||
【实验反思】你认为哪种方案测得的结果更准确?___,请简述理由.___.

▼优质解答
答案和解析
方案I 则赤铁矿粉中氧化铁的质量分数为:
×100%=80%.
方案Ⅱ
设赤铁矿粉中氧化铁的质量为X.
3C+2Fe2O3
4Fe+3CO2
320 132
X 1.32g
=
,
解得:X=3.20g
赤铁矿粉中氧化铁的质量分数为:
×100%=40%
【实验反思】方案I测出的氧化铁的质量分数明显大于方案Ⅱ测出的结果,可能的原因是方案Ⅱ生成的二氧化碳与过量的碳反应生成一氧化碳,不能全部被氢氧化钠溶液吸收.
答案:方案I 80%.
方案Ⅱ40%.
【实验反思】方案I;方案Ⅱ生成的二氧化碳与过量的碳反应生成一氧化碳,不能全部被氢氧化钠溶液吸收.
| 8.00g-1.60g |
| 8.00g |
方案Ⅱ
设赤铁矿粉中氧化铁的质量为X.
3C+2Fe2O3
| ||
320 132
X 1.32g
| 320 |
| X |
| 132 |
| 1.32g |
解得:X=3.20g
赤铁矿粉中氧化铁的质量分数为:
| 3.20g |
| 8.00g |
【实验反思】方案I测出的氧化铁的质量分数明显大于方案Ⅱ测出的结果,可能的原因是方案Ⅱ生成的二氧化碳与过量的碳反应生成一氧化碳,不能全部被氢氧化钠溶液吸收.
答案:方案I 80%.
方案Ⅱ40%.
【实验反思】方案I;方案Ⅱ生成的二氧化碳与过量的碳反应生成一氧化碳,不能全部被氢氧化钠溶液吸收.
看了 为了测定某赤铁矿中氧化铁(F...的网友还看了以下:
(2013•吴中区二模)某水泥厂化验室,为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量 2020-05-17 …
同系物必满足同一通式吗?取代反应与加成反应都一定属于有机反应?取代反应与加成反应都一定属于氧化还原 2020-06-07 …
(2012•哈尔滨模拟)为了测定某石灰石中碳酸钙的质量分数.取石灰石样品,与足量质量分数为7.3% 2020-07-25 …
为了测定某石灰石中碳酸钙的质量分数.取石灰石样品,与足量质量分数为7.3%的稀盐酸在烧杯(烧杯质量 2020-07-25 …
为测定某石灰石样品中CaCO3的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂 2020-07-25 …
取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水)反应前烧杯和稀盐 2021-02-06 …
化学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石 2021-02-06 …
小红同学为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品 2021-02-06 …
某中学化学兴趣小组为了测定某矿山石灰石中碳酸钙的质量分数,取石灰石样品与足量的10%的稀盐酸在烧杯中 2021-02-06 …
为了测定某矿山石灰石中碳酸钙的质量分数,某兴趣小组的同学进行了如下实验:取石灰石样品与足量稀盐酸在烧 2021-02-06 …