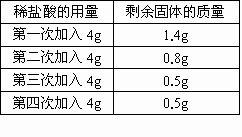
有一种只含SiO2杂质(SiO2不溶于水,也不与盐酸反应)的石灰石样品.某学生想测定该样品中碳酸钙的质量分数,他取用2g样品,把16g稀盐酸平均分4次加入,充分反应后剩余固体
有一种只含SiO 2 杂质(SiO 2 不溶于水,也不与盐酸反应)的石灰石样品.某学生想测定该样品中碳酸钙的质量分数,他取用2g样品,把16g稀盐酸平均分4次加入,充分反应后剩余固体的质量依次记录于下表:
计算:(1)样品中碳酸钙的质量分数?
(2)2g样品与稀盐酸充分反应时,恰好用去稀盐酸的质量为多少克?此时,所得溶液溶质的质量分数为多少?(小数点后保留两位有效数字)
解析:
(1)由题给数据进行对比分析,第二次较第一次溶解了1.4g-0.8g=0.6g,第三次较第二次溶解了0.8g-0.5g=0.3g<0.6g,说明0.5g就是SiO2的质量,则CaCO3的质量为2g-0.5g=1.5g,所以样品中碳酸钙的质量分数为×100%=75%. (2)第三次溶解CaCO3的质量0.3g正好是第二次溶解的一半,则消耗盐酸也只有一半(2g),这样共消耗稀盐酸质量为4g+4g+2g=10g.设生成CaCl2的质量为x,CO2的质量为y. CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 111 44 1.5g x y x=1.67g y=0.66g 生成物中CaCl2的质量分数为×100%=15.4%
有多少个苹果?有一堆苹果10个10个的数剩9个,9个9个的数剩8个,8个8个的数剩7个,7个7个的 2020-04-06 …
取6g石灰石样品分4次滴加稀盐酸每次10g样品中杂质不与盐酸啥的反应滴加稀盐酸反应后剩余固体质量第 2020-04-09 …
一堆苹果,2个人分剩1个,3个人分剩2个,4个人分剩3个,5个人分剩4个,6个人分剩5个,11个人 2020-05-16 …
一道巨难的数学题有一不知何数二二数剩1三三数剩2四四数剩3五五数剩4六六数剩5七七数剩6八八数剩7 2020-06-15 …
有一个题是这样的一堆苹果12个12个数剩11个,11个11个数剩10个10个10个的数剩9个,9个9 2020-11-10 …
一堆苹果,2个2个地数剩1个,3个3个地数剩2个,4个4个地数剩3个,5个5个地数剩4个,6个6个地 2020-11-19 …
一堆苹果,2个2个剩1个一堆苹果,2个2个地数剩1个,3个3个地数剩2个,4个4个地数剩3个,5个5 2020-11-19 …
如果237U在不断的裂变中,每天所剩留质量与上一天剩留质量相比,按同一比例减少,经过7天裂变,剩留的 2020-11-29 …
帮我算一个数.有一堆苹果,10个10个一堆放剩9个,9个9个放剩8个,8个8个放剩7个,7个7个放剩 2020-12-30 …
取石灰石样品6克,把50克稀盐酸分5次加入(已知石灰石样品中含有杂质不溶于水,不与盐酸反应).如上1 2021-02-06 …