早教吧作业答案频道 -->化学-->
甲醇和乙醇是重要的化工原料,也是清洁的能源.(1)工业上利用乙酸甲酯和氢气加成制备乙醇的技术比较成熟.主要反应如下:反应①:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g)△H1反
题目详情
甲醇和乙醇是重要的化工原料,也是清洁的能源.
(1)工业上利用乙酸甲酯和氢气加成制备乙醇的技术比较成熟.主要反应如下:
反应①:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g)△H1
反应②:CH3COOCH3(g)+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)△H2>0
反应③:C2H5OH(g)⇌CH3CHO(g)+H2(g)△H3>0
①分析增大压强对制备乙醇的影响___.
②反应①乙酸甲酯的平衡转化率与温度和氢碳比(
)的关系如图1.
该反应的平衡常数K随温度升高___.(填“变大”“不变”或“变小”);氢碳比最大的是曲线___.
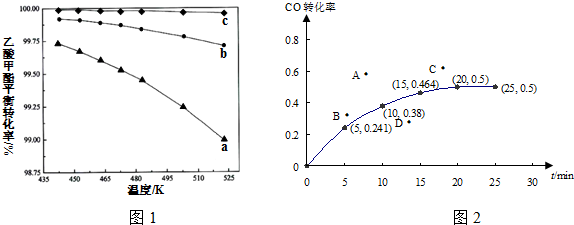
(2)①利用反应CO(g)+2H2(g)⇌CH3OH(g)合成甲醇.某温度下,向容积为2L的密闭容器中加入1mol CO和2mol H2,CO转化率的变化如图2所示,该温度下的平衡常数为___(保留两位有效数字,下同),若起始压强为12.6MPa,则10min时容器的压强为___.
②若保持其它条件不变,起始时加入2mol CO和2mol H2,再次达到平衡,相应的点是___.
(3)氢气可用CH4制备:CH4(g)+H2O(1)⇌CO(g)+3H2(g)△H=+250.1kJ•mol-1.已知CO(g)、H2(g)的燃烧热依次为283.0kJ•mol-1、285.8kJ•mol-1,请写出表示甲烷燃烧热的热化学方程式___.以CH4(g)为燃料可以设计甲烷燃料电池,已知该电池的能量转换效率为86.4%,则该电池的比能量为___kW•h•kg-1(只列计算式,比能量=
,lkW•h=3.6×106J).
(1)工业上利用乙酸甲酯和氢气加成制备乙醇的技术比较成熟.主要反应如下:
反应①:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g)△H1
反应②:CH3COOCH3(g)+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)△H2>0
反应③:C2H5OH(g)⇌CH3CHO(g)+H2(g)△H3>0
①分析增大压强对制备乙醇的影响___.
②反应①乙酸甲酯的平衡转化率与温度和氢碳比(
| n(H2) |
| n(乙酸甲酯) |
该反应的平衡常数K随温度升高___.(填“变大”“不变”或“变小”);氢碳比最大的是曲线___.

(2)①利用反应CO(g)+2H2(g)⇌CH3OH(g)合成甲醇.某温度下,向容积为2L的密闭容器中加入1mol CO和2mol H2,CO转化率的变化如图2所示,该温度下的平衡常数为___(保留两位有效数字,下同),若起始压强为12.6MPa,则10min时容器的压强为___.
②若保持其它条件不变,起始时加入2mol CO和2mol H2,再次达到平衡,相应的点是___.
(3)氢气可用CH4制备:CH4(g)+H2O(1)⇌CO(g)+3H2(g)△H=+250.1kJ•mol-1.已知CO(g)、H2(g)的燃烧热依次为283.0kJ•mol-1、285.8kJ•mol-1,请写出表示甲烷燃烧热的热化学方程式___.以CH4(g)为燃料可以设计甲烷燃料电池,已知该电池的能量转换效率为86.4%,则该电池的比能量为___kW•h•kg-1(只列计算式,比能量=
| 电池输出电能(kW•h) |
| 燃料质量(kg) |
▼优质解答
答案和解析
(1)压强越大反应速率越快,而反应①:CH3COOCH3(g)+2H2(g)⇌CH3OH(g)+C2H5OH(g)正向气体计量数减小,所以平衡正向移动,
反应②:CH3COOCH3(g)+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)两边气体计量数相等,增大压强平衡不移动,反应③:C2H5OH(g)⇌CH3CHO(g)+H2(g)正向气体计量数增加,增大压强平衡逆向移动,故答案为:增大压强,也能提高反应速率.反应①为气体分子数减小的反应,反应②气体分子数不变,反应③为气体分子数变大的反应,增大压强反应①平衡正向移动,反应②平衡不移动,反应③平衡逆向移动,总结果,乙醇含量增大;
②温度越高乙酸甲酯的平衡转化率越小,所以平衡逆向移动,所以正反应是放热反应,所以温度升高K值减小;乙酸甲酯的转化率越小,则氢碳比(
)越大,所以最大的是c,故答案为:变小; c;
(2)①CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常数K=
=
=4.0,
=
,所以P=9.4 MPa,故答案为:4.0;9.4 MPa;
②若保持其它条件不变,起始时加入2mol CO和2mol H2,相当于在原平衡的基础上加入一氧化碳的量,一氧化碳的转化率减小,所以点B符合,故答案为:B;
(3)①CH4(g)+H2O(1)⇌CO(g)+3H2 (g)△H=+250.1kJ.mol-l
②CO(g)+
O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+
O2(g)═H2O(l)△H=-285.8kJ•mol-1
①+②+③×3得
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;
设燃料为1kg,放出的能量为
×890.3KJ×86.4%=4.8×107J;比能量为
,故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;
.
反应②:CH3COOCH3(g)+C2H5OH(g)⇌CH3COOC2H5(g)+CH3OH(g)两边气体计量数相等,增大压强平衡不移动,反应③:C2H5OH(g)⇌CH3CHO(g)+H2(g)正向气体计量数增加,增大压强平衡逆向移动,故答案为:增大压强,也能提高反应速率.反应①为气体分子数减小的反应,反应②气体分子数不变,反应③为气体分子数变大的反应,增大压强反应①平衡正向移动,反应②平衡不移动,反应③平衡逆向移动,总结果,乙醇含量增大;
②温度越高乙酸甲酯的平衡转化率越小,所以平衡逆向移动,所以正反应是放热反应,所以温度升高K值减小;乙酸甲酯的转化率越小,则氢碳比(
| n(H2) |
| n(乙酸甲酯) |
(2)①CO(g)+2H2(g)⇌CH3OH(g)
起始量(mol/L) 0.5 1 0
变化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常数K=
| 生成物平衡浓度幂次方乘积 |
| 反应物平衡浓度幂次方乘积 |
| 0.25 |
| 0.25×0.52 |
| 12.6 |
| 3 |
| P |
| 3-0.38×2 |
②若保持其它条件不变,起始时加入2mol CO和2mol H2,相当于在原平衡的基础上加入一氧化碳的量,一氧化碳的转化率减小,所以点B符合,故答案为:B;
(3)①CH4(g)+H2O(1)⇌CO(g)+3H2 (g)△H=+250.1kJ.mol-l
②CO(g)+
| 1 |
| 2 |
③H2(g)+
| 1 |
| 2 |
①+②+③×3得
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;
设燃料为1kg,放出的能量为
| 1000 |
| 16 |
| 4.8×107J |
| 3.6×106J |
| 4.8×107J |
| 3.6×106J |
看了 甲醇和乙醇是重要的化工原料,...的网友还看了以下:
工业合成氨的反应为N2(G)+3H2(G)———(可逆号,不好打)2NH3(G).设在容积为2L的 2020-06-03 …
已知函数F(X)是正比例函数,函数G(X)是反比例函数,且f(1)=1,g(1)=2.求函数f(x 2020-06-27 …
如图,正方形AOBC的边长为4,反比例函数y=k/x经过正方形的重心D点,E为AO边上任意一点,F 2020-08-01 …
关于G=mg,下列说法正确的是()A.它表示G与m成正比B.它表示G与g成正比C.它表示g与m成反比 2020-10-30 …
关于引力常量G,下列说法中正确的是()A.引力常量G的值是由牛顿第一次比较准确地测出的B.引力常量G 2020-10-30 …
关于恒温恒容化学平衡与转化率的问题比如可逆反应mA(g)+nB(g)=pC(g)+qD(g)按比例增 2020-11-04 …
已知函数f(x)=g(x)+h(g),g(x)关于x²成正比,h(x)关于√x成反比,且g(1)=2 2020-11-29 …
已知函数f(x)=g(x)+h(x),g(x)关于x^2成正比,h(x)关于x成反比,且g(1)=2 2020-12-12 …
用单摆测定重力加速度,根据原理和注意事项正确是()A.由g=4π2lT2看出,T一定时,g与l成正比 2021-01-04 …
下列说法正确的是()A.3O2(g)=2O3(g)△H>0,则可判定O2(g)比O3(g)稳定B.由 2021-02-16 …