早教吧作业答案频道 -->化学-->
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:NaBr+H2SO4(浓)+C2H5OH△NaHSO4+C2H5Br+H2O已知反应物的用量:0.3molNaBr(s);0.25mol乙
题目详情
实验室用NaBr、浓H2SO4、乙醇为原料,制备溴乙烷,反应的化学方程式为:
NaBr+H2SO4(浓)+C2H5OH
NaHSO4+C2H5Br+H2O
已知反应物的用量:0.3mol NaBr(s);0.25mol乙醇;36mL浓硫酸(溶质质量分数为98%,密度为1.84g•mL-1);25mL水,其中乙醇的密度为0.80g•mL-1.回答下列问题:
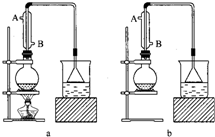
(1)该实验应选择下图中的 (填“a”或“b”)装置.___
(2)反应装置中的烧瓶应选择下列哪种规格最合适___
A.50mLB.100mLC.150mLD.250mL
(3)冷凝管中的冷凝水的流向应是___
A.A进B出B.B进A出C.从A进或B进均可
(4)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有___.
(5)用棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是___,必须使用的仪器是___.
(6)本实验的产率为60%,则可制取溴乙烷___g.
(7)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏.为证明最终得到的产品--溴乙烷中含有溴元素,下列几项实验步骤,其正确的操作顺序是:取少量溴乙烷,然后___(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却.
NaBr+H2SO4(浓)+C2H5OH
| △ |
| |
已知反应物的用量:0.3mol NaBr(s);0.25mol乙醇;36mL浓硫酸(溶质质量分数为98%,密度为1.84g•mL-1);25mL水,其中乙醇的密度为0.80g•mL-1.回答下列问题:

(1)该实验应选择下图中的 (填“a”或“b”)装置.___
(2)反应装置中的烧瓶应选择下列哪种规格最合适___
A.50mLB.100mLC.150mLD.250mL
(3)冷凝管中的冷凝水的流向应是___
A.A进B出B.B进A出C.从A进或B进均可
(4)上述实验完成后,需要将烧瓶中的有机物蒸馏出来,所得馏出液中含有___.
(5)用棕黄色的粗溴乙烷制取无色的溴乙烷应加入的试剂是___,必须使用的仪器是___.
(6)本实验的产率为60%,则可制取溴乙烷___g.
(7)为除去溴乙烷中残留的少量水,可选用无水CaCl2作干燥剂,并蒸馏.为证明最终得到的产品--溴乙烷中含有溴元素,下列几项实验步骤,其正确的操作顺序是:取少量溴乙烷,然后___(填代号).
①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却.
▼优质解答
答案和解析
(1)由题给信息,知该反应为:NaBr+H2SO4(浓)+C2H5OH
NaHSO4+C2H5Br+H2O,反应需要加热,所以应采用装置a,
故答案为:a;
(2)烧瓶的规格与所盛液体的体积有关,加热时烧瓶内液体的体积应小于烧瓶的容积的
,
V(C2H5OH)=
=14cm-3=14mL,忽略混合时体积变化,混合后液体的总体积约为36mL+25mL+14mL=75mL,所以150mL的烧瓶最合适,
故答案为:C;
(3)冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出.
故答案为:B;
(4)可能发生的副反应有:C2H5OH
C2H4↑+H2O,2C2H5OH
C2H5OC2H5+H2O,2HBr+H2SO4(浓)
Br2+SO2↑+2H2O等,
则反应产物混合液中含有C2H5Br、C2H5OC2H5和Br2,所以将烧瓶中的有机物蒸馏出来,所得馏出液中含有C2H5Br、C2H5OC2H5和Br2.
故答案为:C2H5Br、C2H5OC2H5和Br2;
(5)棕黄色的粗溴乙烷,是由于溴乙烷溶解了Br2的缘故,可用NaOH溶液洗涤除去,溴乙烷难溶于水,可以用分液漏斗分离溴乙烷和水溶液;
故答案为:NaOH溶液;分液漏斗
(6)已知n(乙醇)=0.25mol,实验的产率为60%,则n(溴乙烷)=0.25mol×60%=0.15mol,
反应方程式为:NaBr+H2SO4(浓)+C2H5OH
NaHSO4+C2H5Br+H2O,
则m(溴乙烷)=0.15mol×109g/mol=16.35g,
故答案为:16.35.
(7)溴乙烷与氢氧化钠溶液混合加热,溴乙烷水解生成乙醇和NaBr,然后加硝酸中和多余的碱,再向溶液中加硝酸银,生成浅黄色沉淀,说明含有溴离子,即溴乙烷中含有溴元素,所以正确的操作顺序是④①⑤③②;
故答案为:④①⑤③②.
| △ |
故答案为:a;
(2)烧瓶的规格与所盛液体的体积有关,加热时烧瓶内液体的体积应小于烧瓶的容积的
| 2 |
| 3 |
V(C2H5OH)=
| 0.25mol×46g•mol-1 |
| 0.80g•cm-3 |
故答案为:C;
(3)冷凝时,水需充满冷凝器,为了防止冷凝器冷凝时,受热不均匀破裂,冷凝水应下进上出.
故答案为:B;
(4)可能发生的副反应有:C2H5OH
| 浓H2SO4 |
| 170℃ |
| 浓H2SO4 |
| 140℃ |
| ||
则反应产物混合液中含有C2H5Br、C2H5OC2H5和Br2,所以将烧瓶中的有机物蒸馏出来,所得馏出液中含有C2H5Br、C2H5OC2H5和Br2.
故答案为:C2H5Br、C2H5OC2H5和Br2;
(5)棕黄色的粗溴乙烷,是由于溴乙烷溶解了Br2的缘故,可用NaOH溶液洗涤除去,溴乙烷难溶于水,可以用分液漏斗分离溴乙烷和水溶液;
故答案为:NaOH溶液;分液漏斗
(6)已知n(乙醇)=0.25mol,实验的产率为60%,则n(溴乙烷)=0.25mol×60%=0.15mol,
反应方程式为:NaBr+H2SO4(浓)+C2H5OH
| △ |
则m(溴乙烷)=0.15mol×109g/mol=16.35g,
故答案为:16.35.
(7)溴乙烷与氢氧化钠溶液混合加热,溴乙烷水解生成乙醇和NaBr,然后加硝酸中和多余的碱,再向溶液中加硝酸银,生成浅黄色沉淀,说明含有溴离子,即溴乙烷中含有溴元素,所以正确的操作顺序是④①⑤③②;
故答案为:④①⑤③②.
看了 实验室用NaBr、浓H2SO...的网友还看了以下:
设函数f(x)在x=a的某个邻域内有定义,则f(x)在x=a处可导的一个充分条件是?请写出分析过程! 2020-03-30 …
汽车由A地驶往相距120km的B地,它的平均速度是30km/h,则汽车距B地路程s(km)与行驶时 2020-04-07 …
物体自由下落的高度h(米)和下落时间t(秒)的关系是:在地球上大约是h=4.9t2(是4.9乘t的 2020-05-13 …
使用MATLAB进行人工神经网络拟合求助测量一种合金的硬度H,包含四个特征向量A、B、C、D,测试 2020-05-17 …
请问错在哪里,应如何改正>>v=0.7:1.2;>>h=0.1:0.5;>>[h,v]=meshg 2020-06-11 …
在平面直角坐标系中,(1)依次描出下列各点:A(3,6),B(2,4),C(0,3),D(2,2) 2020-06-25 …
某干燥器的生产能力为700kg湿料/h,将湿料由湿基含水量0.4(质量分数)干燥到湿基含水量0.0 2020-07-12 …
用matlab解复杂方程组eq1=sym('(Tg-302)/(1/23.26+0.01/1.1) 2020-07-19 …
导数乘法证明中h是什么意思?(f(x)g(x))'=lim(h→0)[f(x+h)g(x+h)-f 2020-07-22 …
航天飞机升空后一段时间内,第ts时的高度h(t)=5t3+30t2+45t+4,其中h的单位为m, 2020-07-29 …