早教吧作业答案频道 -->化学-->
某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.实验(一)碘含量的测定取0.0100mol•Lˉ1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘
题目详情
某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取.
实验(一) 碘含量的测定
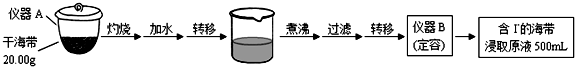
取0.0100mol•Lˉ1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E)反映溶液中c(Iˉ)的变化,部分数据如下表:
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
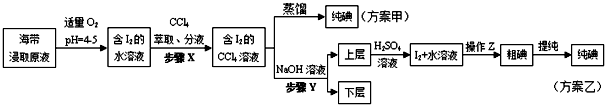
已知:3I2+6NaOH=5NaI+NaIO3+3H2O.
(1)实验(一) 中的仪器名称:仪器A___,仪器B___.
(2)①根据表中数据绘制滴定曲线:
②该次滴定终点时用去AgNO3溶液的体积为___mL,计算得海带中碘的百分含量为___%.(已知碘的相对原子质量为127)
(3)①分液漏斗使用前须检漏,检漏方法为___.
②步骤X中,萃取后分液漏斗内观察到的现象是___.
③下列有关步骤Y的说法,正确的是___.
A.应控制NaOH溶液的浓度和体积 B.将碘转化呈离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是___.
(4)方案甲中采用蒸馏不合理,理由是___.
实验(一) 碘含量的测定

取0.0100mol•Lˉ1的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量.测得的电动势(E)反映溶液中c(Iˉ)的变化,部分数据如下表:
| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
另制海带浸取原液,甲、乙两种实验方案如下:

已知:3I2+6NaOH=5NaI+NaIO3+3H2O.
(1)实验(一) 中的仪器名称:仪器A___,仪器B___.
(2)①根据表中数据绘制滴定曲线:

②该次滴定终点时用去AgNO3溶液的体积为___mL,计算得海带中碘的百分含量为___%.(已知碘的相对原子质量为127)
(3)①分液漏斗使用前须检漏,检漏方法为___.
②步骤X中,萃取后分液漏斗内观察到的现象是___.
③下列有关步骤Y的说法,正确的是___.
A.应控制NaOH溶液的浓度和体积 B.将碘转化呈离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是___.
(4)方案甲中采用蒸馏不合理,理由是___.
▼优质解答
答案和解析
(1)根据仪器的构造可知,用于灼烧海带的仪器为坩埚;通过仪器B配制500mL含有碘离子的浸取液,需要使用500mL的容量瓶,
故答案为:坩埚;500mL容量瓶;
(2)①根据表中数据可以绘制出电动势(E)与消耗硝酸银溶液体积的关系图为: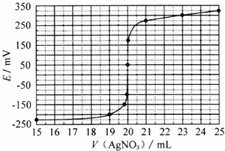 ,
,
故答案为: ;
;
②根据滴定曲线可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液;
20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×
=0.001mol,说明20.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:
×100%=0.635%,
故答案为:20.00mL;0.635;
(3)①检查分液漏斗是否漏水的操作方法为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水,
故答案为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水;
②碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤X向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色,
故答案为:液体分为上下两层,下层呈紫红色;
③A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,故A正确;
B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,故B正确;
C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,将碘转化成离子进入水层,不是除去有机杂质,故C错误;
D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故D错误;
故答案为:AB;
④步骤Z将碘单质和水分离,由于碘单质不溶于水,可通过过滤操作完成,故答案为:过滤;
(4)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理,
故答案为:碘单质易升华,会导致碘损失.
故答案为:坩埚;500mL容量瓶;
(2)①根据表中数据可以绘制出电动势(E)与消耗硝酸银溶液体积的关系图为:
 ,
,故答案为:
 ;
;②根据滴定曲线可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液;
20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×
| 500ml |
| 100ml |
| 127g/mol×0.001mol |
| 20.00g |
故答案为:20.00mL;0.635;
(3)①检查分液漏斗是否漏水的操作方法为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞是否漏水,
故答案为:向分液漏斗中加入少量蒸馏水,检查旋塞处是否漏水,将漏斗倒转过来,检查玻璃塞是否漏水;
②碘单质易溶于有机溶剂,微溶于水,且四氯化碳的密度大于水溶液,所以步骤X向含有碘单质的水溶液中加入四氯化碳后,混合液会分为上下两层,下层为四氯化碳的碘溶液,则下层呈紫红色,
故答案为:液体分为上下两层,下层呈紫红色;
③A.发生反应3I2+6NaOH═5NaI+NaIO3+3H2O中,需要浓氢氧化钠溶液,所以应控制NaOH溶液的浓度和体积,故A正确;
B.根据反应3I2+6NaOH═5NaI+NaIO3+3H2O可知,步骤Y将碘转化成离子进入水层,故B正确;
C.该操作的主要目的是将碘单质转化成碘酸钠、碘化钠,将碘转化成离子进入水层,不是除去有机杂质,故C错误;
D.乙醇易溶于水和四氯化碳,将氢氧化钠换成乙醇,仍然无法分离出碘单质,故D错误;
故答案为:AB;
④步骤Z将碘单质和水分离,由于碘单质不溶于水,可通过过滤操作完成,故答案为:过滤;
(4)方案甲中采用蒸馏操作,由于碘单质容易升华,会导致碘单质损失,所以甲方案不合理,
故答案为:碘单质易升华,会导致碘损失.
看了 某学习小组按如下实验流程探究...的网友还看了以下:
初二数学勾股定理在某海岛D的正西方向有一个观测站C,观测到相距10海里的A,B两船分别位于海岛的南 2020-05-16 …
设测站O点高程HO=37.32m,仪器高i=1.45m,盘左望远镜上仰时读数小于水平时读数90°, 2020-05-20 …
设测站O点高程HO=37.32m,仪器高i=1.45m,盘左望远镜上仰时读数小于水平时读数90°, 2020-05-20 …
一根米尺静止在某参考系S’内相对于S系沿OX和O′X′运动,与O′X′轴成30°角,如果在S系内测 2020-06-14 …
A/O排泥问题:arm:A/O后面有个沉淀池.排泥是只排沉淀池的泥么?如果是这样,想保证A/O的泥 2020-07-07 …
相对论的小题两个惯性系中的观察者O和O'以0.6c的相对速度互相靠近,如果O测得两者的初始距离是20 2020-11-01 …
如图,港口A在观测站O的正东方向,某船从港口A出发,沿北偏东15°方向航行2km到达B处,此时从观测 2020-11-04 …
在某张航海图上,标明三个观测点的坐标:O[0,0],B[6,0],C[6,8],有三个观测点确定的圆 2020-12-21 …
在某张航海图上,标明三个观测点的坐标:O[0,0],B[6,0],C[6,8],有三个观测点确定的圆 2020-12-21 …
2010年8月16日,上海市气象局正式推出短时临近精细化天气监测预报,包括上海中心城区短时临近精细化 2021-01-08 …