早教吧作业答案频道 -->化学-->
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3).其工业流程如图1下:已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100
题目详情
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3).其工业流程如图1下:
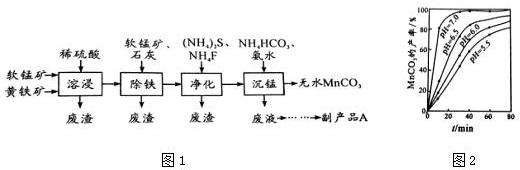
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解.
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)=___〔已知:Ksp(CaF2)=1.46×10-10〕
(2)沉锰工序中,298K、c(Mn2+)为1.05mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图2所示.根据图中信息得出的结论是___.
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、___.
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol•L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应.
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O
MnO2+C2O42-+4H+═Mn2++2CO2↑+2H2O
求该软锰矿中二氧化锰的质量分数___(写出计算过程).

已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解.
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质.若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)=___〔已知:Ksp(CaF2)=1.46×10-10〕
(2)沉锰工序中,298K、c(Mn2+)为1.05mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图2所示.根据图中信息得出的结论是___.
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、___.
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol•L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应.
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O
MnO2+C2O42-+4H+═Mn2++2CO2↑+2H2O
求该软锰矿中二氧化锰的质量分数___(写出计算过程).
▼优质解答
答案和解析
由流程可知软锰矿(主要成分MnO2)和黄铁矿加入硫酸酸浸过滤得到浸出液调节溶液pH,FeS2和稀硫酸反应生成Fe2+,然后过滤得到滤渣是MnO2,向滤液中加入软锰矿发生的离子反应方程式为:2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,过滤,滤液中主要含有Cu2+、Ca2+等杂质,加入硫化铵和氟化铵,除去Cu2+、Ca2+过滤,在滤液中加入碳酸氢铵和氨水沉锰,生成MnCO3沉淀,过滤得到的滤渣中主要含有MnCO3,通过洗涤、烘干得到MnCO3晶体,
(1)已知Ksp(CaF2))=1.46×10-10,c(F-)=0.01 mol•L-1 ,则c(Ca2+)=
=
mol/L=1.46×10-6mol•L-1,
故答案为:1.46×10-6 mol/L;
(2)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3的产率最高;
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥),用水洗去可溶性杂质,用乙醇洗去水分,低温干燥防止碳酸锰分解,
故答案为:先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥);
(4)n(C2O42-)=2.68g÷134g/mol=0.02mol;
滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×10=0.00400mol;
根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.00400mol×5=0.0200mol×2,
n(MnO2)=0.0100mol,
二氧化锰质量分数=
×100%=72.5%,
故答案为:72.5%.
(1)已知Ksp(CaF2))=1.46×10-10,c(F-)=0.01 mol•L-1 ,则c(Ca2+)=
| Ksp |
| c2(F-) |
| 1.46×10-10 |
| 0.012 |
故答案为:1.46×10-6 mol/L;
(2)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:pH等于7.0时反应速率最快,且MnCO3的产率最高;
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥),用水洗去可溶性杂质,用乙醇洗去水分,低温干燥防止碳酸锰分解,
故答案为:先水洗2-3次、再用乙醇洗涤、低温干燥(或低于100℃干燥);
(4)n(C2O42-)=2.68g÷134g/mol=0.02mol;
滴定250mL稀释后溶液,消耗n(MnO4-)=0.0200mol/L×0.0200L×10=0.00400mol;
根据氧化还原反应中得失电子数相等得n(MnO2)×2+0.00400mol×5=0.0200mol×2,
n(MnO2)=0.0100mol,
二氧化锰质量分数=
| 0.0100mol×87g/mol |
| 1.20g |
故答案为:72.5%.
看了 工业上可用软锰矿(主要成分是...的网友还看了以下:
2010年1月20日,某报以“珠三角咸潮敲响警钟水资源大省竟然也叫‘渴’”为题,报道了珠江受严重咸 2020-05-04 …
一般认为,新中国成立以来在1949年、1972年、1992年分别形成了三次建交高潮。下列史实与三次 2020-05-17 …
在“O”里填上合适的字,使它与吓面的字组成成语,并使横向算式成立.O*O-O*O+O*O=34死面 2020-06-23 …
下图反映了新中国成立以三次建交高潮。与这三次高潮成因相对应的选项是()A.中苏建交、尼克松访华、两 2020-07-06 …
这件房子太过潮湿,难以住人英语翻译成 2020-11-23 …
难溶物质能转化成难电离物质吗难溶物质易于转化成更难溶的物质,难电离的易于转化成更难电离的.我想问难溶 2020-12-01 …
咸潮是指沿海地区海水通过河流或其他渠道倒流进内陆区域后,水中的盐分达到或超过250毫克/升的自然灾害 2020-12-26 …
咸潮是指沿海地区海水通过河流或其他渠道倒流进内陆区域后,水中的盐分达到或超过250亳克/升的自然灾害 2020-12-26 …
咸潮是指沿海地区海水通过河流或其他渠道倒流进内陆区域后,水中的盐分达到或超过250亳克/升的自然灾害 2020-12-26 …
咸潮是指沿海地区海水通过河流或其他渠道倒流进内陆区域后,水中的盐分达到或超过250毫克/升的自然灾害 2020-12-26 …