早教吧作业答案频道 -->化学-->
图象法是研究化学反应的焓变的一种常用方法.(1)已知化学反应A2(g)+B2(g)═=2AB(g)的能量变化曲线如图1所示,判断下列叙述中正确的是.A.每生成2molAB时吸收bkJ热量B.该反
题目详情
图象法是研究化学反应的焓变的一种常用方法.
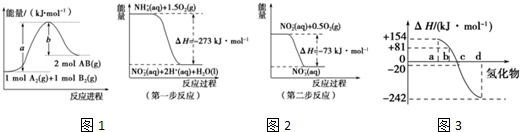
(1)已知化学反应A2(g)+B2(g)═=2AB(g)的能量变化曲线如图1所示,判断下列叙述中正确的是___.
A.每生成2mol AB时吸收 b kJ 热量
B.该反应热△H=+(a-b) kJ•mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A-A和1mol B-B键时放出a kJ能量
(2)在微生物作用的条件下,NH
经过两步反应被氧化成NO
.两步反应的能量变化如2图所示:1mol NH
(aq)全部氧化成NO
(aq)的热化学方程式是___.
(3)图3中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素.
①非金属元素氢化物的稳定性与氢化物生成热△H的关系为___.
②写出硒化氢发生分解反应的热化学方程式___.

(1)已知化学反应A2(g)+B2(g)═=2AB(g)的能量变化曲线如图1所示,判断下列叙述中正确的是___.
A.每生成2mol AB时吸收 b kJ 热量
B.该反应热△H=+(a-b) kJ•mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A-A和1mol B-B键时放出a kJ能量
(2)在微生物作用的条件下,NH
| + 4 |
| - 3 |
| + 4 |
| - 3 |
(3)图3中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素.
①非金属元素氢化物的稳定性与氢化物生成热△H的关系为___.
②写出硒化氢发生分解反应的热化学方程式___.
▼优质解答
答案和解析
(1)A.依据图象分析判断1molA2和1molB2反应生成2molAB,每生成2molAB吸收(a-b) kJ热量,故A错误;
B.由图象可知该反应热△H=+(a-b)kJ•mol-1,故B正确;
C.由图象可知,反应物总能量小于生成物总能量,故C错误;
D.断裂化学键吸收能量,故D错误.
故选B;
(2)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273 kJ•mol-1①,
第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1②,
由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1,
故答案为:NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1;
(3)①非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O,
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
②由①可知,b为硒化氢的生成热数据,则硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
B.由图象可知该反应热△H=+(a-b)kJ•mol-1,故B正确;
C.由图象可知,反应物总能量小于生成物总能量,故C错误;
D.断裂化学键吸收能量,故D错误.
故选B;
(2)由图可知,第一步热化学反应为NH4+ (aq)+1.5O2(g)=2H+(aq)+NO2- (aq)+H2O(l)△H=-273 kJ•mol-1①,
第二步热化学反应为NO2- (aq)+0.5O2(g)=NO3- (aq))△H=-73kJ•mol-1②,
由盖斯定律可知①+②得1mol NH4+(aq)全部氧化成NO3- (aq)的热化学方程式为NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1,
故答案为:NH4+ (aq)+2O2(g)=2H+(aq)+NO3- (aq)+H2O(l)△H=-346 kJ•mol-1;
(3)①非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定,而能量越低越稳定,所以a、b、c、d依次为:H2Te、H2Se、H2S、H2O,
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
②由①可知,b为硒化氢的生成热数据,则硒化氢分解吸热,△H=-81kJ/mol,所以H2Se发生分解反应的热化学反应方程式为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol,
故答案为:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
看了 图象法是研究化学反应的焓变的...的网友还看了以下:
下列说法中,正确的是()A.1molH2SO4与1molBa(OH)2完全中和所放出的热量为中和热 2020-04-08 …
如图纵坐标为反应物的转化率α,横坐标为温度(t℃),下列符合此图情况的反应是()A.C(s)+CO 2020-05-13 …
向绝热恒容密闭容器中只通入A(g)和B(g),在一定条件下使反应A(g)+B(g)C(g)+D(g 2020-05-14 …
焓变条件是不做非体积功,而做了非体积功,何来焓变化学反应A(g)+B(g)=2C(g),A、B 、 2020-05-17 …
(2014•崇明县一模)已知2A(g)+B(g)→2C(g)+Q.下列说法或表达正确的是()A.使 2020-05-17 …
下列热化学方程式书写正确的是(ΔH的绝对值均正确)()A.C2H5OH(l)+3O2(g)===2 2020-07-12 …
斜方硫的燃烧热等于?a:so2(g)的生成热b:so3(g)的生成热c:单斜硫的燃烧热d:零说明原 2020-07-21 …
如图为人体体温调节示意图.下列有关叙述错误的是()A.机体主要通过F、G散热B.A、B两种感受器主要 2020-11-23 …
对于aA(g)+bB(g)cC(g)的平衡体系,加热时体系中混合气体对H2的相对密度增大,下列说法正 2020-12-24 …
已知:2SO2(g)+O2(g)2SO3(g)△H=-196.6kJ•mol-12NO(g)+O2( 2021-02-16 …