早教吧作业答案频道 -->化学-->
废旧电池的回收利用,既能减少废旧电池对环境的污染,又能实现废旧电池的资源化利用.图1是某科技小组,以废旧锌锰干电池为原料,回收及制备多种用途的碳酸锰和相关物质的主要流程
题目详情
废旧电池的回收利用,既能减少废旧电池对环境的污染,又能实现废旧电池的资源化利用.图1是某科技小组,以废旧锌锰干电池为原料,回收及制备多种用途的碳酸锰和相关物质的主要流程:
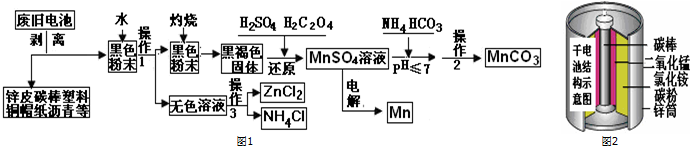
(1)灼烧黑色粉末变成黑褐色是因为有少量MnO2发生了反应生成了少量的MnO,其可能的反应方程式为:___.
(2)还原过程是先加入稀硫酸再加入草酸,写出反应化学方程式:___;在该过程中小组成员甲发现加入硫酸部分固体溶解剩余黑色固体,接着他没有加入草酸而是加入一定量的双氧水,发现固体也完全溶解了,成员乙在加硫酸后也没有加草酸,他又加入了一定量氨水,无明显变化,测得这时溶液的PH值为9,他接着又加入双氧水,发现黑色固体不减反增,写出导致固体增加的离子方程式:___;比较甲、乙两位组员实验你得出的结论是:___.
(3)操作1和操作2使用到相同的装置,操作3的名称是___.
(4)硫酸锰转化为碳酸锰的操作是,在60摄氏度下调节PH值后加入碳酸氢铵溶液,直到不再有气泡产生后再加热反应1小时,写出反应的化学方程式:___.
(5)已知锌锰干电池的总反应为Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl+2MnOOH,写出电池正极的电极___;电解MnSO4溶液回收锰的阳极的电极反应式:___.

(1)灼烧黑色粉末变成黑褐色是因为有少量MnO2发生了反应生成了少量的MnO,其可能的反应方程式为:___.
(2)还原过程是先加入稀硫酸再加入草酸,写出反应化学方程式:___;在该过程中小组成员甲发现加入硫酸部分固体溶解剩余黑色固体,接着他没有加入草酸而是加入一定量的双氧水,发现固体也完全溶解了,成员乙在加硫酸后也没有加草酸,他又加入了一定量氨水,无明显变化,测得这时溶液的PH值为9,他接着又加入双氧水,发现黑色固体不减反增,写出导致固体增加的离子方程式:___;比较甲、乙两位组员实验你得出的结论是:___.
(3)操作1和操作2使用到相同的装置,操作3的名称是___.
(4)硫酸锰转化为碳酸锰的操作是,在60摄氏度下调节PH值后加入碳酸氢铵溶液,直到不再有气泡产生后再加热反应1小时,写出反应的化学方程式:___.
(5)已知锌锰干电池的总反应为Zn+2NH4Cl+2MnO2=Zn(NH3)2Cl+2MnOOH,写出电池正极的电极___;电解MnSO4溶液回收锰的阳极的电极反应式:___.
▼优质解答
答案和解析
(1)废旧锌锰干电池剥离出的黑色粉末中含有碳粉和二氧化锰,碳有还原性,在加热时可将二氧化锰还原成氧化锰,反应的化学方程式为2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑,
故答案为:2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑;
(2)还原过程中草酸将二氧化锰还原成硫酸锰,反应方程式为MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O,根据题中现象描述可知,在酸性条件下双氧水能溶解二氧化锰,说明二氧化锰能氧化双氧水,在碱性条件下,加入双氧水,发现黑色固体不减反增,说明溶液中的锰离子变成了二氧化锰,即双氧水将锰离子氧化成了二氧化锰,反应方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,比较甲、乙两位组员实验可得出的结论是酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO22O2,
故答案为:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O;Mn2++H2O2+2OH-=MnO2↓+2H2O;酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO22O2;
(3)操作1和操作2都是分离固体和液体,都使用过滤的装置,操作3是分离氯化锌和氯化铵,用重结晶的方法,
故答案为:重结晶;
(4)硫酸锰中加入碳酸氢铵溶液生成碳酸锰,同时有气泡产生应为二氧化碳,反应的化学方程式为MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O;
(5)在锌锰干电池中,二氧化锰是氧化剂,在正极发生还原反应生成MnOOH,电极反应式为MnO2+NH4++eˉ=MnO(OH)+NH3,电解MnSO4溶液时,阳极上是水电离出的氢氧根离子放电生成氧气,阴极上是锰离子得电子生成锰,阳极的电极反应式为2H2O-4eˉ=O2↑+4H+(或4OH--4eˉ=O2↑+2H2O),
故答案为:MnO2+NH4++eˉ=MnO(OH)+NH3;2H2O-4eˉ=O2↑+4H+(或4OH--4eˉ=O2↑+2H2O).
故答案为:2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑;
(2)还原过程中草酸将二氧化锰还原成硫酸锰,反应方程式为MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O,根据题中现象描述可知,在酸性条件下双氧水能溶解二氧化锰,说明二氧化锰能氧化双氧水,在碱性条件下,加入双氧水,发现黑色固体不减反增,说明溶液中的锰离子变成了二氧化锰,即双氧水将锰离子氧化成了二氧化锰,反应方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,比较甲、乙两位组员实验可得出的结论是酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO2
故答案为:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O;Mn2++H2O2+2OH-=MnO2↓+2H2O;酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO2
(3)操作1和操作2都是分离固体和液体,都使用过滤的装置,操作3是分离氯化锌和氯化铵,用重结晶的方法,
故答案为:重结晶;
(4)硫酸锰中加入碳酸氢铵溶液生成碳酸锰,同时有气泡产生应为二氧化碳,反应的化学方程式为MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O;
(5)在锌锰干电池中,二氧化锰是氧化剂,在正极发生还原反应生成MnOOH,电极反应式为MnO2+NH4++eˉ=MnO(OH)+NH3,电解MnSO4溶液时,阳极上是水电离出的氢氧根离子放电生成氧气,阴极上是锰离子得电子生成锰,阳极的电极反应式为2H2O-4eˉ=O2↑+4H+(或4OH--4eˉ=O2↑+2H2O),
故答案为:MnO2+NH4++eˉ=MnO(OH)+NH3;2H2O-4eˉ=O2↑+4H+(或4OH--4eˉ=O2↑+2H2O).
看了 废旧电池的回收利用,既能减少...的网友还看了以下:
实行法治是近代社会的重要标志。阅读材料,回答问题。在大革命中,法成了革命的最重要的武器。制宪议会废 2020-07-23 …
下列说法不符合俄国司法改革的是A.亚历山大二世试图全面建立近代司法体系B.建立律师制和陪审制C.废 2020-07-29 …
废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为 2020-11-05 …
废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为 2020-11-05 …
废弃物的综合利用既有利于节约资源,又有利于保护环境.实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为 2020-11-05 …
十月革命后苏维埃政府采取了一系列措施来巩固新生的政权,其中最具有社会主义性质的是A.摧毁旧的国家机器 2020-11-22 …
实验室利用废弃旧电池的铜帽(Zn、Cu总含量约为99%)回收铜并制备ZnO的部分实验过程如图:(1) 2020-12-20 …
巴黎公社在政权建设上为国际社会主义运动提供宝贵的经验是①废除旧军队、旧警察、旧法庭代之以工人阶级自己 2020-12-21 …
《读书》1984年第5期出现这样的诗句:“在倒废纸篓、倒掉了种种旧概念。”1984年秋天,中国取代“ 2021-02-08 …
《读书》1984年第5期出现这样的诗句:“在倒废纸篓、倒掉了种种旧概念。”1984年秋天,中国取代“ 2021-02-08 …