早教吧作业答案频道 -->化学-->
过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题:(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:(2)Na2O2、K2O2、以及BaO2都可与酸作用生成过氧
题目详情
过氧化氢和臭氧是用途很广的氧化剂.试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:___
(2)Na2O2、K2O2、以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得.最适合的过氧化物是___(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ mol-1
H2O2(l)=H2O(l)+
O2(g)△H=-98.64kJ mol-1
H2O(l)=H2O(g)△H=+44kJ mol-1
则反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g) 的△H=___
(4)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:KI+O3+H2O→KOH+I2+O2(未配平) 回答问题:
①还原产物的化学式为___
②配平后的化学方程式是___
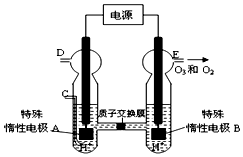
(5)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得.
①图中阴极为___(填“A”或“B”).
②若C处不通入O2,D、E处分别收集到11.2L和有4.48L气体(标准状况下),则E处收集的气体中O3所占的体积分数为___(忽略O3的分解).
③若C处通入O2,则A极的电极反应式为:___.

(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:___
(2)Na2O2、K2O2、以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得.最适合的过氧化物是___(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=-534kJ mol-1
H2O2(l)=H2O(l)+
| 1 |
| 2 |
H2O(l)=H2O(g)△H=+44kJ mol-1
则反应N2H4(g)+2H2O2(l)=N2(g)+4H2O(g) 的△H=___
(4)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:KI+O3+H2O→KOH+I2+O2(未配平) 回答问题:
①还原产物的化学式为___
②配平后的化学方程式是___
(5)O3可由臭氧发生器(原理如图所示)电解稀硫酸制得.
①图中阴极为___(填“A”或“B”).
②若C处不通入O2,D、E处分别收集到11.2L和有4.48L气体(标准状况下),则E处收集的气体中O3所占的体积分数为___(忽略O3的分解).
③若C处通入O2,则A极的电极反应式为:___.
▼优质解答
答案和解析
(1)酸性条件下H2O2氧化KI生成碘单质和水,反应的离子方程式为:H2O2+2I-+2H+═I2+2H2O;
故答案为:H2O2+2I-+2H+═I2+2H2O;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2,过氧化钡是离子化合物,电子式为: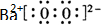 故答案为:
故答案为: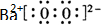 ;
;
(3)N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1①
H2O2(l)=H2O(l)+
O2(g)△H=-98.64kJ mol-1②
H2O(l)═H2O(g),△H=+44kJ•mol-1③
将①+2②+4③可得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=(-534kJ•mol-1)+2×(-98.64kJ•mol-1)+4×(+44kJ•mol-1)=-643.28 kJ•mol-1
故答案为:-643.28 kJ•mol-1;
(4)该反应中臭氧得电子化合价降低,所以臭氧是氧化剂;氧化剂对应的产物是还原产物,所以氢氧化钾是还原产物,碘元素化合价-1价变化为0价,氧元素化合价变化为-2价,结合电子守恒配平书写化学方程式为:2KI+O3+H2O=2KOH+I2+O2;
故答案为:KOH;2KI+O3+H2O=2KOH+I2+O2;
(5)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑,故答案为:A;
②若C处不通入O2,实质为电解水,D处为氢气,体积为11.2 L,物质的量为0.5mol,E处为氧气、臭氧,体积共为4.48L,物质的量为0.2mol;
令臭氧的体积为xL,根据电子转移守恒有
0.5×2=x×3×2+(0.2-x)×2×2,解得Z=0.5mol-2×0.2mol=0.1,所以E处收集的气体中O3所占的体积分数为
×100%=50%,
故答案为:50%;
③C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O.
故答案为:H2O2+2I-+2H+═I2+2H2O;
(2)实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,说明生成了硫酸钡沉淀,所以选用BaO2,过氧化钡是离子化合物,电子式为:
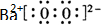 故答案为:
故答案为: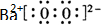 ;
;(3)N2H4(l)+O2(g)═N2(g)+2H2O(g),△H=-534kJ•mol-1①
H2O2(l)=H2O(l)+
| 1 |
| 2 |
H2O(l)═H2O(g),△H=+44kJ•mol-1③
将①+2②+4③可得:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=(-534kJ•mol-1)+2×(-98.64kJ•mol-1)+4×(+44kJ•mol-1)=-643.28 kJ•mol-1
故答案为:-643.28 kJ•mol-1;
(4)该反应中臭氧得电子化合价降低,所以臭氧是氧化剂;氧化剂对应的产物是还原产物,所以氢氧化钾是还原产物,碘元素化合价-1价变化为0价,氧元素化合价变化为-2价,结合电子守恒配平书写化学方程式为:2KI+O3+H2O=2KOH+I2+O2;
故答案为:KOH;2KI+O3+H2O=2KOH+I2+O2;
(5)①由图可知,B极生成O2、O3,B极反应氧化反应,电解池阳极发生氧化反应,故A为阴极,电极反应为2H++2e-═H2↑,故答案为:A;
②若C处不通入O2,实质为电解水,D处为氢气,体积为11.2 L,物质的量为0.5mol,E处为氧气、臭氧,体积共为4.48L,物质的量为0.2mol;
令臭氧的体积为xL,根据电子转移守恒有
0.5×2=x×3×2+(0.2-x)×2×2,解得Z=0.5mol-2×0.2mol=0.1,所以E处收集的气体中O3所占的体积分数为
| 0.1mol |
| 0.2mol |
故答案为:50%;
③C处通入O2,O2发生还原反应,在酸性条件下生成水,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O.
看了 过氧化氢和臭氧是用途很广的氧...的网友还看了以下:
已知烯烃、炔烃在臭氧的作用下发生以下反应:CH3-CH═CH-CH2-CH═CH2→CH3CHO+ 2020-05-04 …
亚都KJF2202T空气净化器的净化方式会产生臭氧吗?它的净化方式是分解,但化学分解的主要工作原理 2020-05-14 …
如何简单测试臭氧发生器产生臭氧?我买了一台150元的立式饮水机,它有臭氧消毒功能,我不知道它是否有 2020-05-17 …
干燥的氢氧化钾与臭氧作用生成臭氧化钾的条件请从理论分析一下 2020-07-04 …
下列关于臭氧的叙述正确的是(两个选项不太懂)B、打雷时、高压电机和复印机工作时均会产生臭氧.C、臭氧 2020-11-20 …
已知烯烃经臭氧氧化作用可发生如下反应:相似能发生加氢还原反应,即酮或醛均可与氢气在一定条件下发生还原 2020-11-22 …
1995年诺贝尔化学奖授予致力于研究臭氢层被破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外 2020-11-30 …
打雷时空气中有臭氧生成,高压电机和复印机工作时也会产生臭氧。下列说法中错误的是A.O3和O2互为同素 2020-12-01 …
等离子空气净化器在工作时会产生臭氧(O3),臭氧是一种公认的高效空气杀菌剂,但达到一定浓度时对人体也 2020-12-10 …
某校文印室里有两台复印机长期工作着,使用和操作复印机的师傅,时常感到身体有不适的现象.一天,一位学生 2021-01-12 …