早教吧作业答案频道 -->化学-->
分解水制氢气的工业制法之一是硫.碘循环,主要涉及下列反应:ⅠSO2+2H20+I2═H2SO4+2HIⅡ2HI⇌H2+I2Ⅲ2H2SO4═2SO2+O2+2H2O(1)分析上述反应,下列判断正确的是a.反应Ⅲ易在常温下进行b.反
题目详情
分解水制氢气的工业制法之一是硫.碘循环,主要涉及下列反应:
ⅠSO2+2H20+I2═H2SO4+2HI
Ⅱ2HI⇌H2+I2
Ⅲ2H2SO4═2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是___
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中S02还原性比HI强
c.循环过程中需补充H20 d.循环过程中产生lmol02的同时产生lmolH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图1所示.0~2min内的平均反应速率v(HI)=___.该温度下,反应2HI(g)⇌H2(g)+I2(g)的平衡常数表达式为K=___.相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则___是原来的2倍.
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
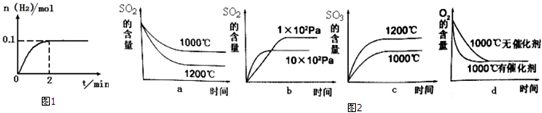
(3)S02在一定条件下可氧化生成S03,其主反应为:2S02 (g)+02(g)⇌2S03(g)AH<O,
若此反应起始的物质的量相同,则图2关系图正确的是___
实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是___
(4)实际生产用氨水吸收S02生成亚硫酸的铵盐.现取a克该铵盐,若将其中的S02全部反应出来,应加入18.4mol/L的硫酸溶液的体积范围为___.
ⅠSO2+2H20+I2═H2SO4+2HI
Ⅱ2HI⇌H2+I2
Ⅲ2H2SO4═2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是___
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中S02还原性比HI强
c.循环过程中需补充H20 d.循环过程中产生lmol02的同时产生lmolH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图1所示.0~2min内的平均反应速率v(HI)=___.该温度下,反应2HI(g)⇌H2(g)+I2(g)的平衡常数表达式为K=___.相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则___是原来的2倍.
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数

(3)S02在一定条件下可氧化生成S03,其主反应为:2S02 (g)+02(g)⇌2S03(g)AH<O,
若此反应起始的物质的量相同,则图2关系图正确的是___
实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是___
(4)实际生产用氨水吸收S02生成亚硫酸的铵盐.现取a克该铵盐,若将其中的S02全部反应出来,应加入18.4mol/L的硫酸溶液的体积范围为___.
▼优质解答
答案和解析
(1)a.硫酸常温下温度,不易分解,故a错误;
b.反应中二氧化硫表现还原性,还原性比HI强,故b正确;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故答案为:bc;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
=0.05mol/L,用氢气表示的化学反应速率为
=0.025mol/(L.min),
由反应中的化学计量数可知v(HI)=0.025mol/(L.min)×2=0.05mol/(L.min);根据方程式可写出平衡常数表达式为:K=
;
对该反应,当温度不变开始加入HI(g)的物质的量是原来的2倍,则温度不变,K不变,故a错;物质的量为原来的2倍,该反应是反应前后气体体积相等的反应,
则反应体系中各物质的浓度都是原来的2倍,故b正确;物质的量增大,则化学反应速率先增大的快,后随浓度的减小,速率增大的程度变小,故c错;
由反应方程式及原来的量与后来的量成正比,则这两种情况下建立的平衡为等效平衡,即平衡时H2的体积分数相同,故d错;
故答案为:0.05mol•L-1•min-1;
;b;
(3)升高温度,加快反应速率到达平均的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低,二氧化硫的含量升高,故a错误,b正确;增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,二氧化硫的含量减少,图象与实际不符合,故c错误;使用催化剂,能加快反应速率,缩短达到平衡的时间,但不影响平衡,故d正确;
实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是催化剂的活性较高、加快反应速率,
故选:bd;催化剂的活性较高、加快反应速率;
(4)设ag亚硫酸铵完全转化为二氧化硫消耗硫酸的体积为x,设ag亚硫酸氢铵完全转化为二氧化硫消耗硫酸的体积为y:
(NH4)2SO3 ~H2SO4
116 1mol
ag 18.4x
=
,解得x=
L
2NH4HSO3 ~H2SO4
198g 1mol
ag 18.4y
=
,解得y=
L,
因氨气和二氧化硫反应可能生成亚硫酸铵或亚硫酸氢铵或为亚硫酸铵和亚硫酸酸氢铵的混合物,故消耗硫酸的范围为:
L~
L,
故答案为:
L~
L.
b.反应中二氧化硫表现还原性,还原性比HI强,故b正确;
c.1molSO2消耗2molH2O生成1molH2SO4,1molH2SO4分解生成1molSO2与1molH2O,循环中水的量减少,故应补充水,故c正确;
d.由Ⅲ可知产生lmolO2的同时产生2molSO2,由I可知2molSO2生成4molHI,由Ⅱ可知4molHI分解生成2mol H2,即循环过程中产生l mol O2的同时产生2mol H2,故d错误;
故答案为:bc;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
| 0.1mol |
| 2L |
| 0.05mol/L |
| 2min |
由反应中的化学计量数可知v(HI)=0.025mol/(L.min)×2=0.05mol/(L.min);根据方程式可写出平衡常数表达式为:K=
| c(H2)c(I2) |
| c2(HI) |
对该反应,当温度不变开始加入HI(g)的物质的量是原来的2倍,则温度不变,K不变,故a错;物质的量为原来的2倍,该反应是反应前后气体体积相等的反应,
则反应体系中各物质的浓度都是原来的2倍,故b正确;物质的量增大,则化学反应速率先增大的快,后随浓度的减小,速率增大的程度变小,故c错;
由反应方程式及原来的量与后来的量成正比,则这两种情况下建立的平衡为等效平衡,即平衡时H2的体积分数相同,故d错;
故答案为:0.05mol•L-1•min-1;
| c(H2)c(I2) |
| c2(HI) |
(3)升高温度,加快反应速率到达平均的时间缩短,逆反应速率增大更多,平衡向逆反应方向移动,三氧化硫的含量降低,二氧化硫的含量升高,故a错误,b正确;增大压强,加快反应速率到达平均的时间缩短,正反应速率增大更多,平衡向正反应方向移动,二氧化硫的含量减少,图象与实际不符合,故c错误;使用催化剂,能加快反应速率,缩短达到平衡的时间,但不影响平衡,故d正确;
实际工业生产使用的条件是:常压、五氧化二钒、500℃,选择该温度条件的原因是催化剂的活性较高、加快反应速率,
故选:bd;催化剂的活性较高、加快反应速率;
(4)设ag亚硫酸铵完全转化为二氧化硫消耗硫酸的体积为x,设ag亚硫酸氢铵完全转化为二氧化硫消耗硫酸的体积为y:
(NH4)2SO3 ~H2SO4
116 1mol
ag 18.4x
| 116g |
| ag |
| 1mol |
| 18.4x |
| a |
| 116×18.4 |
2NH4HSO3 ~H2SO4
198g 1mol
ag 18.4y
| 198g |
| a |
| 1mol |
| 18.4y |
| a |
| 198×18.4 |
因氨气和二氧化硫反应可能生成亚硫酸铵或亚硫酸氢铵或为亚硫酸铵和亚硫酸酸氢铵的混合物,故消耗硫酸的范围为:
| a |
| 116×18.4 |
| a |
| 198×18.4 |
故答案为:
| a |
| 116×18.4 |
| a |
| 198×18.4 |
看了分解水制氢气的工业制法之一是硫...的网友还看了以下:
判断题 1.一个多位数的各位数字之和被9除余2则这个数被9除也余2.2.循环小数6.37(7上循环 2020-05-13 …
如图,在△ABC中,AB=AC,点D在BC上,BD=DC,过点D作DE⊥AC,垂足为E,O经过A, 2020-06-12 …
如图,在△ABC中,∠A=∠B=30°,过点C作CD⊥AC,交AB于点D.(1)作⊙O,使⊙O经过 2020-06-22 …
环戊、己烯与高猛酸钾(H+)反应为什么环己烯环断开,而环戊烯环不断开环己烯生成HOOC-CH2-C 2020-07-08 …
化学方程式:4HCl+O2=CuO400℃2Cl2+2H2O且O-O键断裂释放498kl/mol, 2020-07-19 …
如图,AB是⊙O的直径,AF是⊙O的切线,CD是垂直于AB的弦,垂足为E,过点C作DA的平行线与A 2020-07-21 …
如图,已知:在⊙O中,AB是⊙O的直径,弦CD垂直平分OA,垂足为E,连接AC、BC、BD、OD. 2020-07-31 …
在极坐标系Ox中,Rt△OPQ的顶点O、P、Q按逆时针方向排列,∠OPQ=π2,∠POQ=π3,点 2020-08-02 …
(2014•从化市一模)如图,已知在Rt△ABC中,∠C=90°,AD是∠BAC的平分线.(1)作一 2020-11-06 …
关于一道题对功率的提问小环O和O′分别套在不动的竖直杆AB和A′B′上,一根不可伸长的绳子穿过环O′ 2021-01-10 …