早教吧作业答案频道 -->化学-->
硫一碘循环分解水制氢主要涉及下列反应:Ⅰ、SO2+2H2O+I2═H2SO4+2HIⅡ、2HI═H2+I2Ⅲ、2H2SO4═2SO2↑+O2↑+2H2O(1)分析上述反应,下列判断正确的是.a.反应Ⅲ易在常温下进行b.反应
题目详情
硫一碘循环分解水制氢主要涉及下列反应:
Ⅰ、SO2+2H2O+I2═H2SO4+2HI
Ⅱ、2HI═H2+I2
Ⅲ、2H2SO4═2SO2↑+O2↑+2H2O
(1)分析上述反应,下列判断正确的是___.
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2Od.循环过程中产生1mol O2的同时产生1mol H2
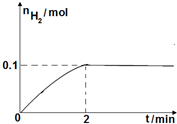
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
0~2min内的平均反应速率v(HI)=___.
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列试剂中的___,产生H2的速率将增大(填字母).
a.NaNO3b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池.
已知2H2(g)+O2(g)═2H2O(l)△H=-572KJ•mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为___.
(5)利用氢气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=___;
(6)判断该可逆反应达到化学平衡状态的标志是___(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(7)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的___倍.
Ⅰ、SO2+2H2O+I2═H2SO4+2HI
Ⅱ、2HI═H2+I2
Ⅲ、2H2SO4═2SO2↑+O2↑+2H2O

(1)分析上述反应,下列判断正确的是___.
a.反应Ⅲ易在常温下进行 b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2Od.循环过程中产生1mol O2的同时产生1mol H2
(2)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示.
0~2min内的平均反应速率v(HI)=___.
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列试剂中的___,产生H2的速率将增大(填字母).
a.NaNO3b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制成氢氧燃料电池.
已知2H2(g)+O2(g)═2H2O(l)△H=-572KJ•mol-1
某氢氧燃料电池释放228.8KJ电能时,生成1mol液态水,该电池的能量转化率为___.
(5)利用氢气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)═CH3OH(g);△H=-90.8kJ•mol-1
②2CH3OH(g)═CH3OCH3(g)+H2O(g);△H=-23.5kJ•mol-1
③CO(g)+H2O(g)═CO2(g)+H2(g);△H=-41.3kJ•mol-1
总反应:3H2(g)+3CO(g)═CH3OCH3(g)+CO2 (g)的△H=___;
(6)判断该可逆反应达到化学平衡状态的标志是___(填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(7)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2反应生成CH3OH(g),达到平衡时CO的转化率为90%,此时容器内的压强为开始时的___倍.
▼优质解答
答案和解析
(1)a.因硫酸在常温下稳定,则反应Ⅲ常温下不发生,故a错;
b.由反应Ⅰ可知,还原剂的还原性大于还原产物的还原性,则还原性SO2>HI,即SO2的氧化性比HI的弱,故b错;
c.由反应Ⅰ×2+Ⅱ×2+Ⅲ可得到2H2O═2H2+O2,则该循环中消耗水,需要及时补充水,故c正确;
d.Ⅰ、2SO2+4H2O+2I2═2H2SO4+4HI
Ⅱ、4HI═2H2+2I2
Ⅲ、2H2SO4═2SO2↑+O2↑+2H2O
循环过程中产生1molO2的同时产生2molH2,故d错,
故答案为:c;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
=0.1mol/L,用氢气表示的化学反应速率为
=0.05mol/(L.min),反应速率之比等于化学方程式计量数之比,0~2min内的平均反应速率v(HI)=2V(H2)=2×0.05mol/(L.min)=0.1mol/(L.min),
故答案为:0.1mol/(L.min);
(3)a.若加入NaNO3溶液形成的稀硝酸具有硝酸的强氧化性,则不会生成氢气,故a错误;
b.加入CuSO4 后,Zn与硫酸铜溶液反应置换出Cu,在溶液中形成原电池反应,则构成原电池加快了化学反应速率,故b正确;
c.Na2SO4 的加入,离子不参与反应,则对化学反应速率无影响,故c错误;
d.加入NaHSO3会和H+反应,降低c(H+),则反应速率减慢,故d错误;
故答案为:b;
(4)由2H2(g)+O2(g)═2H2O(I)△H=-572KJ.mol-1可知,生成1mol水时放出的热量为572KJ×
=286KJ,
则电池的能量转化率为为
×100%=80%,故答案为:80%.
(5)已知:①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.8kJ/mol,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol,
故答案为:-246.4kJ/mol;
(6)2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ/mol,反应是气体体积减小的放热反应,
a.反应速率之比等于化学方程式计量数之比为正反应速率速率之比,v生成(CH3OH)=v消耗(CO)反应是正反应速率之比,只能说明反应正向进行,不能说明反应达到平衡状态,故a错误;
b.反应前后气体质量不变,体积不变,混合气体的密度始终不改变,不能说明反应达到平衡状态,故b错误;
c.反应前后气体物质的量变化,气体质量不变,则混合气体的平均相对分子质量不再改变说明反应达到平衡状态,故c正确;
d.CO、H2、CH3OH的浓度均不再变化,是化学平衡的标志,故d正确;
故答案为:cd;
(7)根据题意得到:CO(g)+2H2(g)⇌CH3OH(g)
初始物质的量(mol) 2.5 7.5 0
变化的物质的量(mol) 2.25 4.5 2.25
平衡的物质的量 (mol)0.25 3 2.25
气体压强之比等于气体物质的量之比,所以此时容器内的压强和开始时的比值为(0.25+3+2.25):( 2.5+7.5)=0.55,
故答案为:0.55.
b.由反应Ⅰ可知,还原剂的还原性大于还原产物的还原性,则还原性SO2>HI,即SO2的氧化性比HI的弱,故b错;
c.由反应Ⅰ×2+Ⅱ×2+Ⅲ可得到2H2O═2H2+O2,则该循环中消耗水,需要及时补充水,故c正确;
d.Ⅰ、2SO2+4H2O+2I2═2H2SO4+4HI
Ⅱ、4HI═2H2+2I2
Ⅲ、2H2SO4═2SO2↑+O2↑+2H2O
循环过程中产生1molO2的同时产生2molH2,故d错,
故答案为:c;
(2)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为
| 0.1mol |
| 1L |
| 0.1mol/L |
| 2min |
故答案为:0.1mol/(L.min);
(3)a.若加入NaNO3溶液形成的稀硝酸具有硝酸的强氧化性,则不会生成氢气,故a错误;
b.加入CuSO4 后,Zn与硫酸铜溶液反应置换出Cu,在溶液中形成原电池反应,则构成原电池加快了化学反应速率,故b正确;
c.Na2SO4 的加入,离子不参与反应,则对化学反应速率无影响,故c错误;
d.加入NaHSO3会和H+反应,降低c(H+),则反应速率减慢,故d错误;
故答案为:b;
(4)由2H2(g)+O2(g)═2H2O(I)△H=-572KJ.mol-1可知,生成1mol水时放出的热量为572KJ×
| 1 |
| 2 |
则电池的能量转化率为为
| 228.8KJ |
| 286KJ |
(5)已知:①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.8kJ/mol,
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.4kJ/mol,
故答案为:-246.4kJ/mol;
(6)2H2(g)+CO(g)═CH3OH(g)△H=-90.8kJ/mol,反应是气体体积减小的放热反应,
a.反应速率之比等于化学方程式计量数之比为正反应速率速率之比,v生成(CH3OH)=v消耗(CO)反应是正反应速率之比,只能说明反应正向进行,不能说明反应达到平衡状态,故a错误;
b.反应前后气体质量不变,体积不变,混合气体的密度始终不改变,不能说明反应达到平衡状态,故b错误;
c.反应前后气体物质的量变化,气体质量不变,则混合气体的平均相对分子质量不再改变说明反应达到平衡状态,故c正确;
d.CO、H2、CH3OH的浓度均不再变化,是化学平衡的标志,故d正确;
故答案为:cd;
(7)根据题意得到:CO(g)+2H2(g)⇌CH3OH(g)
初始物质的量(mol) 2.5 7.5 0
变化的物质的量(mol) 2.25 4.5 2.25
平衡的物质的量 (mol)0.25 3 2.25
气体压强之比等于气体物质的量之比,所以此时容器内的压强和开始时的比值为(0.25+3+2.25):( 2.5+7.5)=0.55,
故答案为:0.55.
看了硫一碘循环分解水制氢主要涉及下...的网友还看了以下:
从H+、Cu2+、Na+、SO42-、Cl-中选择适当的离子组成电解质,使之符合下列要求.(1)以 2020-05-13 …
周末,我帮妈妈去买菜.①买2千克牛肉和5千克鸡蛋一共需要多少钱?②请你再提出一个数学问题,并列式解 2020-05-13 …
阅读下面的例题:解方程:x2+|x|-2=0.解:原方程可化为:|x|2+|x|-2=0即:(|x 2020-05-13 …
求极限1:lim[(n-3)/(2n-1)]∧2.要解法 2:因为:lim[1+(1/n)]∧n= 2020-05-16 …
1.要将10升浓度为40%的盐水变为浓度为20%的盐水,要加水多少升?(方程解)2.要配制浓度为3 2020-05-16 …
晓东在解一元二次方程时,发现有这样一种解法:如:解方程x(x+4)=6.解:原方程可变形,得[(x 2020-06-11 …
我们知道方程ax=b的解有三种情况:1.当a≠0时,有唯一解,2.当a=0,且b≠0时,无解,3. 2020-06-14 …
英语翻译还有几个问题:1.解释带点字:王适更新衣()是有数也()..2.上文叙述了河南王哪两件事, 2020-06-20 …
已知关于x的方程x2+kx-2=0.(1)求证:不论k取何值,方程总有两个不相等的实数根.(2)若 2020-06-27 …
阅读下列解方程的过程,并填空题目解方程1x+2+4xx2−4=2x−2[解]方程两边同时乘以(x+ 2020-06-27 …