早教吧作业答案频道 -->化学-->
(1)已知反应2HI(g)⇌H2(g)+I2(g)的△H=+11kJ/mol,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为kJ.(2
题目详情
(1)已知反应 2HI(g)⇌H2(g)+I2(g)的△H=+11kJ/mol,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为___kJ.
(2)Bodensteins 研究了下列反应:2HI(g)⇌H2(g)+I2(g)在 716K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为___.
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为___(以K和k正表示).若 k正=0.0027min-1,在 t=40min 时,v正=___ min-1.
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示.当升高到某一温度时,反应重新达到平衡,相应的点依次为___(填字母)和___(填字母).
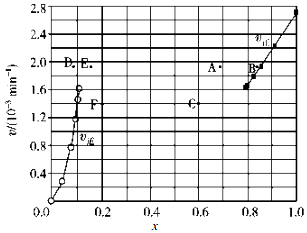
(2)Bodensteins 研究了下列反应:2HI(g)⇌H2(g)+I2(g)在 716K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为___(以K和k正表示).若 k正=0.0027min-1,在 t=40min 时,v正=___ min-1.
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示.当升高到某一温度时,反应重新达到平衡,相应的点依次为___(填字母)和___(填字母).

▼优质解答
答案和解析
(1)设1molHI(g)分子中化学键断裂时需吸收的能量为x kJ,可知2x kJ-436kJ-151kJ=11kJ,解得x=299,
故答案为:299;
(2)①根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,其化学平衡常数K=
=
,
故答案为:
;
②该反应达到平衡状态时正逆反应速率相等,v正=k正x2(HI)=v逆=k逆x(H2)x(I2),则k逆=k正.
=
,若k正=0.0027min-1,在t=40min时,v正=0.0027min-1×0.852=1.95×10-3min-1,
故答案为:
;1.95×10-3;
③对于2HI(g)⇌H2(g)+I2(g)反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;
对于H2(g)+I2(g)⇌2HI(g)反应建立平衡时:
升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;
因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,
故答案为:A;E.
故答案为:299;
(2)①根据表中数据知,反应达到平衡状态时,HI的物质的量分数是0.784,碘和氢气的物质的量分数相等为0.108,其化学平衡常数K=
| c(H2)c(I2) |
| c2(HI) |
| 0.1082 |
| 0.7842 |
故答案为:
| 0.1082 |
| 0.7842 |
②该反应达到平衡状态时正逆反应速率相等,v正=k正x2(HI)=v逆=k逆x(H2)x(I2),则k逆=k正.
| x(HI)2 |
| x(H2)x(I2) |
| K正 |
| K |
故答案为:
| K正 |
| K |
③对于2HI(g)⇌H2(g)+I2(g)反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;
对于H2(g)+I2(g)⇌2HI(g)反应建立平衡时:
升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;
因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,
故答案为:A;E.
看了(1)已知反应2HI(g)⇌H...的网友还看了以下:
在一个不导热的密闭反应中,只发生两个反应a(g)+b(g)=2c(g),焓变小于0x(g)+3y( 2020-04-26 …
已知可逆反应:M(g)+N(g)===(可逆符号)P(g)+Q(g);△H>0.(为?.已知可逆反 2020-04-27 …
低温下,反应CO(g)+NO2(g)==CO2(g)+NO(g)的速率方程是υ=k{c(NO2)} 2020-05-14 …
求一道化学平衡题一定温度下,在一个容积为1L的密闭容器中,充入1molH2(g)和1molI2(g 2020-05-22 …
现有下列反应H2(g)+CO2(g)=H2O(g)+CO(g),此反应在1259K下达到平衡.现有 2020-05-23 …
对于反应Cl2(g)+2NO(g)2NOCl(g),实验发现,如两反应物浓度都加倍,则反应速率增至 2020-05-24 …
反应2NO(g)+O2(g)=2NO2(g),H=114kJ/mol,S=-146J/molK.反 2020-06-13 …
化学反应2SO2(g)+O2(g)2SO3(g)是硫酸制造工业的基本反应.将0.050molSO2 2020-06-23 …
(1)将1molI2(g)和2molH2置于某2L密闭容器中,在一定温度下发生反应:I2(g)+H 2020-07-15 …
1.将5molN2(g)和5molH2(g)混合生成1molNH3(g)时,反应N2(g)+3H2( 2020-12-19 …