早教吧作业答案频道 -->化学-->
甲醇是重要的化工原料,利用CO2和H2合成甲醇,发生的主反应如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H已知:在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.70kJ.请写出表示甲
题目详情
甲醇是重要的化工原料,利用CO2和H2合成甲醇,发生的主反应如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H
已知:在 25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.请写出表示甲醇燃烧热的热化学方程式___.
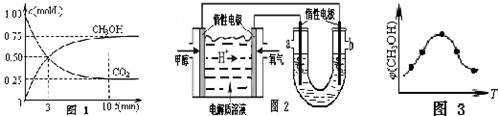
(1)在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.
回答:
0~10min 内,氢气的平均反应速率为___mol/(L•min);第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),则平衡___(填“正向”、“逆向”或“不”)移动.恒温恒压密闭容器中该反应达平衡状态的依据是(填序号)___.
A.v正(CH3OH)=3v逆(H2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,该装置中 a 极为___极,负极反应式为___.在电解一段时间后,NaCl溶液的pH值变为12(假设NaCl 溶液的体积不变),则理论上消耗甲醇的物质的量为___mol.
(3)取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H___0(填“>”、“<”或“=”).

已知:在 25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.请写出表示甲醇燃烧热的热化学方程式___.
(1)在一恒温恒容密闭容器中充入1mol CO2和3mol H2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.
回答:
0~10min 内,氢气的平均反应速率为___mol/(L•min);第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),则平衡___(填“正向”、“逆向”或“不”)移动.恒温恒压密闭容器中该反应达平衡状态的依据是(填序号)___.
A.v正(CH3OH)=3v逆(H2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(2)如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,该装置中 a 极为___极,负极反应式为___.在电解一段时间后,NaCl溶液的pH值变为12(假设NaCl 溶液的体积不变),则理论上消耗甲醇的物质的量为___mol.
(3)取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H___0(填“>”、“<”或“=”).
▼优质解答
答案和解析
已知:在 25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ,32g甲醇燃烧生成二氧化碳和液态水放热726.40KJ,甲醇燃烧的热化学方程式为CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.40KJ/mol,
故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.40KJ/mol;
(1)图象分析可知,甲醇变化浓度为0.75mol/L,甲醇的反应速率v(CH3OH)=
=0.075mol/(L•min ),反应速率之比等于化学方程式计量数之比,v(H2)=3v(CH3OH)=3×0.075mol/(L•min )=0.225mol/(L•min ),结合化学三行计算得到,图象分析可知体积为1L,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
该温度下平衡常数K=
=5.3
第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),
Qc=
=4.5<K=5.3,反应正向进行,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)反应是气体体积减小的反应,恒温恒压密闭容器中该反应达平衡状态的依据是正逆反应速率相同是化学平衡的标志,
A.反应速率之比等于化学方程式计量数之比为正反应速率之比,当3v正(CH3OH)=v逆(H2),说明氢气正逆反应速率相同,表示反应达到平衡状态,v正(CH3OH)=3v逆(H2)不能说明反应达到平衡状态,故A错误;
B.反应前后气体质量相同,恒温恒压密闭容器中混合气体的密度不变,能说明反应达到平衡状态,故B正确;
C.甲醇和水蒸气浓度浓度和起始量变化量有关,c(CH3OH)=c(H2O)不能说明反应达到平衡状态,故C错误;
D.反应前后气体物质的量变化,混合气体的总物质的量不变说明反应达到平衡状态,故D正确;
故答案为:0.225,正向,B D;
(2)在甲醇燃料电池(电解质溶液为稀硫酸)中,正极发生还原反应,即O2放电,甲醇在负极失电子发生氧化反应,与甲醇电极相连的b为原电池阴极,与通入氧气的电极相连的a为阳极,根据电解质溶液为酸性溶液,得出正极反应为:O2+4e-+4H+=2H2O,负极电极反应为:CH3OH-6e-+H2O=CO2+6H+,
NaCl溶液的pH值变为12,即得出△n(OH-)=10-2mol/L×0.3L=0.003mol=△n(H+),根据电解池中阴极的电极反应2H++2e-=H2↑可知:
电解池的阴极得0.003mol电子.而流经四个电极的电量相等,根据燃料电池的负极反应CH3OH-6e-+H2O=CO2+6H+可知CH3OH~6e-,故失0.003mol电子时消耗0.0005mol甲醇.
故答案为:阳,CH3OH-6e-+H2O=CO2+6H+,0.0005;
(3)由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0,故答案为:<.
| 3 |
| 2 |
故答案为:CH3OH(l)+
| 3 |
| 2 |
(1)图象分析可知,甲醇变化浓度为0.75mol/L,甲醇的反应速率v(CH3OH)=
| 0.75mol/L |
| 10min |
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始量(mol/L) 1 3 0 0
变化量(mol/L) 0.75 2.25 0.75 0.75
平衡量(mol/L) 0.25 0.75 0.75 0.75
该温度下平衡常数K=
| 0.75×0.75 |
| 0.25×0.753 |
第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5mol H2O(g),
Qc=
| (0.75+1.5)×0.75 |
| 0.25×(0.75+0.75) |
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)反应是气体体积减小的反应,恒温恒压密闭容器中该反应达平衡状态的依据是正逆反应速率相同是化学平衡的标志,
A.反应速率之比等于化学方程式计量数之比为正反应速率之比,当3v正(CH3OH)=v逆(H2),说明氢气正逆反应速率相同,表示反应达到平衡状态,v正(CH3OH)=3v逆(H2)不能说明反应达到平衡状态,故A错误;
B.反应前后气体质量相同,恒温恒压密闭容器中混合气体的密度不变,能说明反应达到平衡状态,故B正确;
C.甲醇和水蒸气浓度浓度和起始量变化量有关,c(CH3OH)=c(H2O)不能说明反应达到平衡状态,故C错误;
D.反应前后气体物质的量变化,混合气体的总物质的量不变说明反应达到平衡状态,故D正确;
故答案为:0.225,正向,B D;
(2)在甲醇燃料电池(电解质溶液为稀硫酸)中,正极发生还原反应,即O2放电,甲醇在负极失电子发生氧化反应,与甲醇电极相连的b为原电池阴极,与通入氧气的电极相连的a为阳极,根据电解质溶液为酸性溶液,得出正极反应为:O2+4e-+4H+=2H2O,负极电极反应为:CH3OH-6e-+H2O=CO2+6H+,
NaCl溶液的pH值变为12,即得出△n(OH-)=10-2mol/L×0.3L=0.003mol=△n(H+),根据电解池中阴极的电极反应2H++2e-=H2↑可知:
电解池的阴极得0.003mol电子.而流经四个电极的电量相等,根据燃料电池的负极反应CH3OH-6e-+H2O=CO2+6H+可知CH3OH~6e-,故失0.003mol电子时消耗0.0005mol甲醇.
故答案为:阳,CH3OH-6e-+H2O=CO2+6H+,0.0005;
(3)由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,升高温度平衡吸热方向进行,逆反应为吸热反应,则正反应为放热反应,即△H<0,故答案为:<.
看了甲醇是重要的化工原料,利用CO...的网友还看了以下:
判断下列各组单词括号内部分发音是否相同.h(o)td(o)g()cl(o)ckc(o)ffee() 2020-06-26 …
①HCl和NaOH反应的中和热△H=-57.3KJ/mol,则(H₂SO₄)和Ca(OH)₂反应的 2020-06-27 …
基础闯关全练水滴石穿全面过关?答案P1311.下列加点字的注音有误的一项是()A.耸立(sǒng) 2020-07-02 …
.下列词语中,加点的字读音全部正确的一组是()A.东皋(gǎo)迤(yǐ)逦央浼(měi)少不更( 2020-07-02 …
下列加点字注音有误的一项是()A.巉(chán)蒙茸(róng)黄泥之坂(bǎn)B.冯(féng 2020-07-02 …
下列各项中字音不正确的一项是:()A.涕(tì)泪梯(tī)子府第(dì)B.饿莩(fú)俘(fú 2020-07-12 …
下面各组读音中,没有错误的一组是:A.给予jǐ犒劳gào肖像xiào少不更事gēnB.着陆zháo瓜 2020-12-15 …
下列各项中字音不正确的一项是:()A.暴虐(nüè)怅寥廓(chàng)峥嵘(róng)B.遒劲(q 2020-12-23 …
选出下列词语中注音有误的一项:()A.幕mù后墓mù地倒塌tā下榻tàB.糟蹋tà竹篙gāo枯槁gā 2020-12-26 …
算法复杂度计算中Max{f,g}=O(f+g)是否正确?如果正确的话错误的话请举例.注意,需要证明的 2021-01-14 …