早教吧作业答案频道 -->化学-->
据粗略统计,我国没有处理排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染.为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚,其中甲醇
题目详情
据粗略统计,我国没有处理排放的焦炉煤气已超过250亿立方米,这不仅是能源的浪费,也对环境造成极大污染.为解决这一问题,我国在2004年起已利用焦炉煤气制取甲醇及二甲醚,其中甲醇产量在2012年末已达到500~600万吨.请回答下列问题:
(1)已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)⇌CH3OH(g)△H1.如表所列为常见化学键的键能数据:
则该反应的△H1=___ kJ•mol-1.
(2)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.已知利用焦炉气合成二甲醚的三步反应如下:
ⅰ.2H2(g)+CO(g)⇌CH3OH(g)△H1
ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
ⅲ.CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.3kJ•mol-1
①总反应:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=___kJ•mol-1.
②下列描述中能说明上述总反应已达平衡的是___.
A.c(H2)、c(CO)、c(CH3OCH3)、c(CO2)均为0.1mol•L-1
B.2v(H2)正=v(CH3OCH3)逆
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成n mol H2
③一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是___.
a.增大压强 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)①甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图甲,该燃料电池的电池反应式为2CH3OH (g)+3O2(g)═2CO2(g)+4H2O(l),则正极的电极反应式为___.
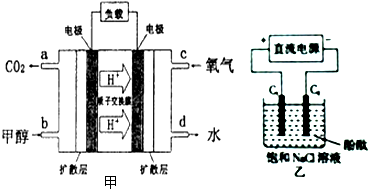
②用上述电池做电源,用图乙装置电解饱和食盐水(C1、C2均为石墨电极),该反应的离子方程式为___,电解初始在电极___(填“C1”或“C2”)的周围先出现红色.
③当有8g甲醇完全反应,在C2上可收集到标准状况下气体的体积为___.
(1)已知CO中的C与O之间为三键连接,且合成甲醇的主要反应原理为CO(g)+2H2(g)⇌CH3OH(g)△H1.如表所列为常见化学键的键能数据:
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
(2)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用.已知利用焦炉气合成二甲醚的三步反应如下:
ⅰ.2H2(g)+CO(g)⇌CH3OH(g)△H1
ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
ⅲ.CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.3kJ•mol-1
①总反应:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=___kJ•mol-1.
②下列描述中能说明上述总反应已达平衡的是___.
A.c(H2)、c(CO)、c(CH3OCH3)、c(CO2)均为0.1mol•L-1
B.2v(H2)正=v(CH3OCH3)逆
C.容器中气体的压强保持不变
D.单位时间内生成n mol CO的同时生成n mol H2
③一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是___.
a.增大压强 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(3)①甲醇-空气燃料电池(DMFC)是一种高效能、轻污染电动汽车的车载电池,其工作原理示意图如图甲,该燃料电池的电池反应式为2CH3OH (g)+3O2(g)═2CO2(g)+4H2O(l),则正极的电极反应式为___.

②用上述电池做电源,用图乙装置电解饱和食盐水(C1、C2均为石墨电极),该反应的离子方程式为___,电解初始在电极___(填“C1”或“C2”)的周围先出现红色.
③当有8g甲醇完全反应,在C2上可收集到标准状况下气体的体积为___.
▼优质解答
答案和解析
(Ⅰ)(1)CO(g)+2H2(g)⇌CH3OH (g),反应的焓变可以根据反应物的总键能和生成物的总键能计算得到,焓变=反应物总键能之和-生成物总键能之和,依据图表提供的化学键的键能计算得到,△H1═1032KJ/mol+2×436KJ/mol-(3×414KJ/mol+326.8KJ/mol+464KJ/mol)=-128.8 kJ•mol-1,
故答案为:-128.8;
(2)①ⅰ.2H2(g)+CO(g)⇌CH3OH(g)△H1=-128.8 kJ•mol-1
ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
ⅲ.CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.3kJ•mol-1
依据盖斯定律计算ii+iii+i×2得到反应的热化学方程式:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-322.4KJ/mol,
故答案为:-322.4;
②3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-322.4KJ/mol,总反应是气体体积减小的放热反应,
A.c(H2)、c(CO)、c(CH3OCH3)、c(CO2)均为0.1mol•L-1 ,不能证明正逆反应速率相同,不能说明反应达到平衡状态,故A错误;
B.反应速率之比等于化学方程式计量数之比,为正反应速率之比,当v(H2)正=3v(CH3OCH3)逆 时,甲醚正逆反应速率相同反应达到平衡状态,所以
2v(H2)正=v(CH3OCH3)逆,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量变化,当容器中气体的压强保持不变说明反应达到平衡状态,故C正确;
D.单位时间内生成n mol CO的同时生成n mol H2,说明反应逆向进行,不能说明反应达到平衡状态,故D错误;
故答案为:C;
③a.压强增大,平衡向正反应方向移动,CO转化率增大,故a正确;
b.催化剂可以增大反应速率,不改变化学平衡,CO转化率不变,故b错误;
c.减少CO2的浓度平衡向正反应反应移动,CO转化率增大,故c正确;
d.增加CO的浓度,CO的转化率反而减小,故d错误;
e.分离出二甲醚平衡向正反应反应移动,CO转化率增大,故e正确,
故答案为:a c e;
(3)①酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子,则负极的电极反应式为:CH3OH+H2O-6e-═CO2+6H+;
正极氧气得到电子结合氢离子反应生成水,正极电极反应式为:4H++4e-+O2=2H2O,
故答案为:O2+4H++4e-=2H2O;
②图乙装置电解饱和食盐水(C1、C2均为石墨电极),该反应是溶液中氢离子在阴极C2电极得到电子生成氢气,水电离平衡正向进行,氢氧根离子浓度增大,溶液中酚酞变红色,氯离子在阳极C1电极失电子生成氯气,反应的离子方程式为:2Cl-+2H2O
2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O
2OH-+Cl2↑+H2↑,C2;
③原电池负极电极反应CH3OH+H2O-6e-═CO2+6H+,和电解池阴极电极反应2H++2e-=H2↑存在电子守恒,CH3OH~3H2↑~6e-,当有8g甲醇完全反应物质的量=
=0.25mol,在C2上可收集到标准状况下气体的体积=0.25mol×3×22.4L/mol=16.8L,
故答案为:16.8L;
故答案为:-128.8;
(2)①ⅰ.2H2(g)+CO(g)⇌CH3OH(g)△H1=-128.8 kJ•mol-1
ⅱ.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-1
ⅲ.CO(g)+H2O(g)⇌CO2(g)+H2(g)△H3=-41.3kJ•mol-1
依据盖斯定律计算ii+iii+i×2得到反应的热化学方程式:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-322.4KJ/mol,
故答案为:-322.4;
②3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=-322.4KJ/mol,总反应是气体体积减小的放热反应,
A.c(H2)、c(CO)、c(CH3OCH3)、c(CO2)均为0.1mol•L-1 ,不能证明正逆反应速率相同,不能说明反应达到平衡状态,故A错误;
B.反应速率之比等于化学方程式计量数之比,为正反应速率之比,当v(H2)正=3v(CH3OCH3)逆 时,甲醚正逆反应速率相同反应达到平衡状态,所以
2v(H2)正=v(CH3OCH3)逆,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量变化,当容器中气体的压强保持不变说明反应达到平衡状态,故C正确;
D.单位时间内生成n mol CO的同时生成n mol H2,说明反应逆向进行,不能说明反应达到平衡状态,故D错误;
故答案为:C;
③a.压强增大,平衡向正反应方向移动,CO转化率增大,故a正确;
b.催化剂可以增大反应速率,不改变化学平衡,CO转化率不变,故b错误;
c.减少CO2的浓度平衡向正反应反应移动,CO转化率增大,故c正确;
d.增加CO的浓度,CO的转化率反而减小,故d错误;
e.分离出二甲醚平衡向正反应反应移动,CO转化率增大,故e正确,
故答案为:a c e;
(3)①酸性条件下,负极上甲醇失电子和水反应生成二氧化碳和氢离子,则负极的电极反应式为:CH3OH+H2O-6e-═CO2+6H+;
正极氧气得到电子结合氢离子反应生成水,正极电极反应式为:4H++4e-+O2=2H2O,
故答案为:O2+4H++4e-=2H2O;
②图乙装置电解饱和食盐水(C1、C2均为石墨电极),该反应是溶液中氢离子在阴极C2电极得到电子生成氢气,水电离平衡正向进行,氢氧根离子浓度增大,溶液中酚酞变红色,氯离子在阳极C1电极失电子生成氯气,反应的离子方程式为:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
③原电池负极电极反应CH3OH+H2O-6e-═CO2+6H+,和电解池阴极电极反应2H++2e-=H2↑存在电子守恒,CH3OH~3H2↑~6e-,当有8g甲醇完全反应物质的量=
| 8g |
| 32g/mol |
故答案为:16.8L;
看了据粗略统计,我国没有处理排放的...的网友还看了以下:
判断一项会计事项是否具有重要性,主要取决于会计制度的规定,而不是取决于会计人员的职业判断。 2020-05-17 …
Simon模型描述决策制定的过程,该过程分为情报收集、方案设计、方案选择和决策实施后的评价阶段。其 2020-05-24 …
(信息给予题)除了十进制计数法,人类还发明了其他的计数法.例如:二进制、八进制、十二进制、六十进制 2020-06-08 …
用74LS161设计一个起始状态为0011的九进制计数器.用74LS161设计一个起始状态为001 2020-07-17 …
管理会计的基本内容可概括为()和控制与业绩评价会计两大部分。A、预算会计B.预测与决策会计C.规划与 2020-11-03 …
政府权力的行使包括决策、执行、监督等环节,其中首要环节是决策。政府的决策关系国计民生,下列体现政府政 2020-11-05 …
机制与制度关系机制决定制度,还是制度决定机制?亦或其他关系? 2020-11-21 …
两个数的比较举个例子说吧,有54个人对某个决议进行表决,其中29人同意,25人反对,请问这2组人有统 2020-11-29 …
当你遭遇不法分子的侵害时,应该①与其进行殊死搏斗,坚决捍卫自己的合法权益,决不妥协。②有能力将其制服 2020-12-01 …
下列关于中山装的表述不正确的是A.其发明与孙中山有关B.综合中式服装与西式服装的特点C.其设计带有反 2020-12-05 …