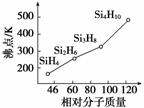
硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是。(2)(2012·福建)硼砂是含结晶水的
硅烷(Si n H 2 n +2 )的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是__________________________________________________。
(2)(2012·福建)硼砂是含结晶水的四硼酸钠,其阴离子X m - (含B、O、H三种元素)的球棍模型如图所示:
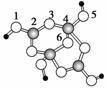
①在X m - 中,硼原子轨道的杂化类型有____________;配位键存在于________原子之间(填原子的数字标号); m =________(填数字)。
②硼砂晶体由Na + 、X m - 和H 2 O构成,它们之间存在的作用力有________(填序号)。
A.离子键 B.共价键 C.金属键 D.范德华力 E.氢键
(3)(2012·山东节选)金属镍在电池、合金、催化剂等方面应用广泛。
①过渡金属配合物Ni(CO) n 的中心原子价电子数与配体提供电子总数之和为18,则 n =________。CO与N 2 结构相似,CO分子内σ键与π键个数之比为________。
②甲醛(H 2 C===O)在Ni催化作用下加氢可得甲醇(CH 3 OH)。甲醇分子内C原子的杂化方式为________________________________________________________________________,
甲醇分子内的O—C—H键角________(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
汽油是现代交通工具的主要能源,汽油的主要成分辛烷(C8H18),下列有关说法正确的是()A.汽油是 2020-05-13 …
相同质量的甲烷、乙烷、丙烷和丁烷完全燃烧并将气态产物全部通入足量过氧化钠粉末中,并未完全吸收,则固 2020-05-13 …
已知某烷烃中的碳氢质量比为5:1(1)确定该烷烃的分子式,计算烷烃的相对分子质量(2)写出该烷烃在 2020-05-14 …
一些烷烃的燃烧热(kJ/mol)如表:下列表达正确的是()。A.热稳定性:正丁烷>异丁烷B.乙烷燃 2020-05-14 …
下列关系正确的是()A.熔点:正戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷B.密度:CCl 2020-05-14 …
下列关系正确的是()A.熔、沸点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷B.密度:CH 2020-05-14 …
相同质量的下列烷烃完全燃烧时耗氧量最多的是()A.甲烷B.乙烷C.丙烷D.丁相同质量的下列烷烃完全 2020-06-25 …
常用燃烧法测定某物质的组成.现取3.2g某物质在足量的氧气中充分燃烧,生成4.4g二氧化碳和3.6 2020-07-18 …
标准状况下,7.84L甲烷和丙烷混合气体7g,求丙烷质量分数乙烷和丙烷混合气体,完全燃烧生成CO22 2020-11-28 …
天然气的主要成分是甲烷.由甲烷的化学式“CH4”获得的信息正确的是()A.甲烷的相对分子质量是16g 2021-01-22 …