早教吧作业答案频道 -->化学-->
向100g稀硫酸溶液中加入一定量的镁粉,待固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀的质量与加入NaOH溶液的质量关系如图所示,请回答下列问题:(1)OA段无
题目详情
向100g稀硫酸溶液中加入一定量的镁粉,待固体完全溶解后,再向所得溶液中加入质量分数为20%的NaOH溶液,所得沉淀的质量与加入NaOH溶液的质量关系如图所示,请回答下列问题:
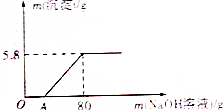
(1)OA段无沉淀产生的原因(用化学方程式表示):___;
(2)加入镁粉的质量为___g;
(3)求加入80g NaOH溶液时,充分反应后的溶液(不饱和溶液)中溶质的质量分数和产生氢气的质量(写出计算过程).

(1)OA段无沉淀产生的原因(用化学方程式表示):___;
(2)加入镁粉的质量为___g;
(3)求加入80g NaOH溶液时,充分反应后的溶液(不饱和溶液)中溶质的质量分数和产生氢气的质量(写出计算过程).
▼优质解答
答案和解析
(1)开始没有沉淀生成,说明硫酸过量,所以OA段是硫酸和NaOH溶液反应生成硫酸钠和水,反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O;
(2)生成沉淀氢氧化镁中镁元素的质量即为加入镁粉的质量,由图可知生成氢氧化镁的质量为5.8g,所以加入镁粉的质量=
×100%×5.8g=2.4g;
(3)设氢气的质量为x.
H2SO4+Mg=MgSO4+H2↑
24 2
2.4g x
=
x=0.2g
答:产生氢气的质量是0.2g.
根据题中的反应原理可知,镁和硫酸反应生成硫酸镁和氢气,硫酸镁和氢氧化钠会生成硫酸钠和氢氧化镁沉淀,硫酸和氢氧化钠会生成硫酸钠和水,所以可以运用氢氧化钠全部转化成硫酸钠进行计算,
反应后的溶液质量100g+2.4g+80g-0.2g=182.2g,
生成硫酸钠的质量为y,
2NaOH→Na2SO4
80 142
80g×20% y
=
y=28.4g,
所以溶质的质量分数为:
×100%=15.6%.
故答案为:(1)H2SO4+2NaOH=Na2SO4+2H2O;
(2)2.4;
(3)0.2g,15.6%.
(2)生成沉淀氢氧化镁中镁元素的质量即为加入镁粉的质量,由图可知生成氢氧化镁的质量为5.8g,所以加入镁粉的质量=
| 24 |
| 24+(16+1)×2 |
(3)设氢气的质量为x.
H2SO4+Mg=MgSO4+H2↑
24 2
2.4g x
| 24 |
| 2.4g |
| 2 |
| x |
x=0.2g
答:产生氢气的质量是0.2g.
根据题中的反应原理可知,镁和硫酸反应生成硫酸镁和氢气,硫酸镁和氢氧化钠会生成硫酸钠和氢氧化镁沉淀,硫酸和氢氧化钠会生成硫酸钠和水,所以可以运用氢氧化钠全部转化成硫酸钠进行计算,
反应后的溶液质量100g+2.4g+80g-0.2g=182.2g,
生成硫酸钠的质量为y,
2NaOH→Na2SO4
80 142
80g×20% y
| 80 |
| 80g×20% |
| 142 |
| y |
y=28.4g,
所以溶质的质量分数为:
| 28.4g |
| 182.2g |
故答案为:(1)H2SO4+2NaOH=Na2SO4+2H2O;
(2)2.4;
(3)0.2g,15.6%.
看了向100g稀硫酸溶液中加入一定...的网友还看了以下:
名言补充:“不为瓦全”的上一句.及“视死忽如归”的上一句.注意是名言! 2020-03-30 …
谁能告诉我全的高一英语捷径40天啊一定要是1到40天的, 2020-03-31 …
下列各项中填在横线上最得体的一项是()某校学生吴笑天在全国作文大赛中获得一等奖。校长在国旗下讲话时 2020-05-13 …
有谁知到“谁知得,平生高尚,五福自然全”的上一句是什么,出自哪里? 2020-05-13 …
下列说法中正确的是(全选对的得4分,选不全的得2分,有多选或错选的得0分)A.布朗运动表明,组成固 2020-05-15 …
人有悲欢离和,月有阴晴圆缺,此事古难全.的下一句 2020-05-17 …
宇宙中是否存在完全不受到力的影响的区域? 完全的在一个空间位置不移动? 2020-05-17 …
一段路长15千米,第一时走了全长得三分之一,第二时走了全长得四分之一.两时共走了多少千米? 2020-05-20 …
信息网络安全的第一个时代()。A、九十年代中叶B、九十年代中叶前C、世纪之交D、专网时代 2020-05-26 …
只可意会的后一句,失之毫厘的后一句,皮之不存的后一句,不为瓦全的前一句,城门失火的后一句, 2020-06-06 …