早教吧作业答案频道 -->化学-->
电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4•6H2O晶体,实现有害物质的资源化利用.已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降
题目详情
电镀污泥主要含有Cr2O3、NiO和Fe2O3等物质,可制备Na2Cr2O7溶液和NiSO4•6H2O晶体,实现有害物质的资源化利用.已知黄钠铁矾[NaFe3(SO4)2(OH)6]是一种浅黄色的难溶物,具有沉淀颗粒大、沉降速率快、容易过滤的特点.
(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为___.
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式:___.
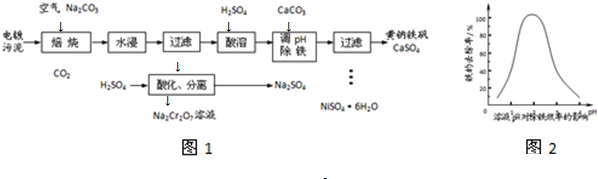
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率.溶液pH对除铁效率影响如图2所示.
则除铁时应控制溶液的pH为___(填序号).
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为___.
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是___.
(4)从滤液中获取NiSO4•6H2O晶体的操作为___、冷却结晶、过滤、___、
干燥.

(1)焙烧时Cr2O3被氧化为Na2CrO4,该反应的化学方程式为___.
(2)写出酸化时CrO42-转化为Cr2O72-的离子方程式:___.
(3)①加入CaCO3的目的是中和溶液中的酸,调节溶液pH,提高铁的去除率.溶液pH对除铁效率影响如图2所示.
则除铁时应控制溶液的pH为___(填序号).
A.0.5~1.5 B.1.5~2.5 C.2.5~3.5
②除铁时发生反应的离子方程式为___.
③若除铁时pH稍大会生成Fe(OH)3胶体,显著降低除铁效率,原因是___.
(4)从滤液中获取NiSO4•6H2O晶体的操作为___、冷却结晶、过滤、___、
干燥.
▼优质解答
答案和解析
将电镀污泥、碳酸钠和空气焙烧,发生反应2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2↑,然后水浸Na2CrO4溶于水、NiO和Fe2O3难溶于水,然后过滤得到滤液,向滤液中加入稀硫酸,发生反应2CrO42-+2H+=Cr2O72-+H2O,然后利用物质的溶解度不同分离得到硫酸钠和Na2Cr2O7溶液;
向滤渣中加入稀硫酸,发生反应NiO+H2SO4=NiSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,向溶液中加入CaCO3来中和溶液中的酸,同时调节溶液的pH,根据图2知,pH为1.5-2.5时铁元素的去除率较大,根据流程图知,生成的沉淀有NaFe3(SO4)2(OH)6、CaSO4,所以去除铁元素时发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑,然后过滤得到沉淀NaFe3(SO4)2(OH)6、CaSO4和溶液NiSO4,然后采用蒸发浓缩、冷却结晶方法得到NiSO4•6H2O晶体,
(1)通过以上分析知,三氧化二铬和碳酸钠、氧气在高温下反应方程式为2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2↑,
故答案为:2Cr2O3+4Na2CO3+3O2
4Na2CrO4+4CO2↑;
(2)根据以上分析知,酸性条件下CrO42-和氢离子反应生成Cr2O72-和水,离子方程式为2CrO42-+2H+=Cr2O72-+H2O,故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(3)①根据图2知,pH在0-3左右,pH越大铁元素的去除率越高,pH>3后,pH越大铁元素的去除率减小,铁的去除率在pH为1.5-2.5时较高,故选B;
②根据以上分析知,发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑,
故答案为:3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑;
③胶体颗粒小,沉淀速率慢且不容易过滤,导致除铁效率低,故答案为:生成Fe(OH)3胶体的颗粒小、沉淀速率慢、不容易过滤等;
(4)从溶液中获取晶体的方法为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,蒸发浓缩增大溶液浓度,洗涤除去杂质,故答案为:蒸发浓缩;洗涤.
| ||
向滤渣中加入稀硫酸,发生反应NiO+H2SO4=NiSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,向溶液中加入CaCO3来中和溶液中的酸,同时调节溶液的pH,根据图2知,pH为1.5-2.5时铁元素的去除率较大,根据流程图知,生成的沉淀有NaFe3(SO4)2(OH)6、CaSO4,所以去除铁元素时发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑,然后过滤得到沉淀NaFe3(SO4)2(OH)6、CaSO4和溶液NiSO4,然后采用蒸发浓缩、冷却结晶方法得到NiSO4•6H2O晶体,
(1)通过以上分析知,三氧化二铬和碳酸钠、氧气在高温下反应方程式为2Cr2O3+4Na2CO3+3O2
| ||
故答案为:2Cr2O3+4Na2CO3+3O2
| ||
(2)根据以上分析知,酸性条件下CrO42-和氢离子反应生成Cr2O72-和水,离子方程式为2CrO42-+2H+=Cr2O72-+H2O,故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(3)①根据图2知,pH在0-3左右,pH越大铁元素的去除率越高,pH>3后,pH越大铁元素的去除率减小,铁的去除率在pH为1.5-2.5时较高,故选B;
②根据以上分析知,发生的离子反应方程式为3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑,
故答案为:3Fe3++3CaCO3+Na++5SO42-+3H2O=NaFe3(SO4)2(OH)6+3CaSO4+3CO2↑;
③胶体颗粒小,沉淀速率慢且不容易过滤,导致除铁效率低,故答案为:生成Fe(OH)3胶体的颗粒小、沉淀速率慢、不容易过滤等;
(4)从溶液中获取晶体的方法为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,蒸发浓缩增大溶液浓度,洗涤除去杂质,故答案为:蒸发浓缩;洗涤.
看了电镀污泥主要含有Cr2O3、N...的网友还看了以下:
初一上册数学题,求速度解答!!!!!!!!已知a,b为常数,且三个单项式4xy2,axy(b)这里 2020-05-13 …
如图是玉米和黄豆种子结构图.请根据图回答:(1)玉米种子和黄豆种子都具有的结构是1和2,1和2分别 2020-05-13 …
从财产保险经营内容的整体和某一具体的财产保险业务经营内容出发,财产保险的复杂性体现在()A.保 2020-05-22 …
初二的!机械功、功率检测题最好把下面题目序号写清楚点,太乱不要.急~~~?一,填空题:1.做功的二 2020-06-07 …
1.三个连续奇数的和为a,这三个连续奇数分别为(),()和().2.一辆客车载满50人,如果在6站 2020-06-10 …
10元可以买一个文具盒和2支笔,如果只买一个文具盒和一只笔,还剩5角.一支铅笔多少钱?一个文具盒少 2020-06-20 …
3个文具盒和2支钢笔共72元,2个文具盒和3支钢笔共78元,问一个文具和一支钢笔各多少元?(不要方 2020-06-20 …
邀丶俯丶瀑丶峭丶躯丶津丶蕴丶侠.的拼音和2一3个词语 2020-06-27 …
10元可以买一个文具盒和2支铅筀,如果只买一个文具盒和一支铅笔还剩5角.一支铅笔多少元?一个文具盒 2020-06-30 …
1+2+2=41+2+3+2+1=91+2+3+4+3+2+1=161+2+3+4+5+4+3+2 2020-07-18 …