已知:I2+2S2O===S4O+2I-。某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入
已知:I2+2S2O 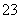 ===S4O
===S4O 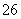 +2I-。
+2I-。
某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用________作滴定指示剂,滴定终点的现象是________________________________。
②CuCl2溶液与KI反应的离子方程式为____________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________。
室温下取0.2mol·L-1HA溶液与0.2mol·L-1NaOH溶液等体积混合(忽略混合后溶液体 2020-05-13 …
某二元酸(H2A)按下式发生电离:H2A=H++HA-;HA- H++A2-.关于下列四种溶液的说 2020-05-16 …
help0.5体积某气态烃只能与0.5体积氯气发生加成反应,生成氯代烷.0.5mol此氯代烷可与3 2020-05-16 …
浮筒式仪表适用于测量比密度在( )的液体液面。A.0--0.5B.0.5--1.5C.1.5--2. 2020-06-07 …
H-1、H-2、H-3与0-16、0-17、0-18六种核素,组成水的分子类型总数是:( )A.6种 2020-06-07 …
0.1mol·L-1的甲酸与0.1mol·L-1的氢氧化钠等体积混合,下列表示所得溶液中的粒子浓度 2020-07-24 …
下列溶液中粒子的物质的量浓度关系正确的是()A.NaH2PO4溶液PH<7,则在溶液中:c(Na+ 2020-07-26 …
作出函数y1=2x-4与y2=-2x+8的图象,并观察图象回答下列问题:(1)x取何值时,2x-4> 2020-11-01 …
江湖救急,(-1)2n+(-1)2n+1=(n为正整数).如果一个数的平方等于这个数的绝对值,则这个 2020-12-19 …
1.比较下列各数大小.(1)-5/8与-7/11(2)|-7.8|与0(3)-(-2)与-(1.比较 2021-01-11 …