早教吧作业答案频道 -->化学-->
某实验小组同学模拟工业制碘的方法,探究ClO3-和I-的反应规律.实验操作及现象如表:实验及试剂编号无色NaClO3溶液用量试管中溶液颜色淀粉KI试纸颜色10.05mL浅黄
题目详情
某实验小组同学模拟工业制碘的方法,探究ClO3-和I-的反应规律.实验操作及现象如表:
(1)取实验2后的溶液,进行如图实验:
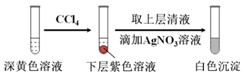
经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:___.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.
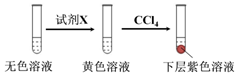
其中试剂X可以是___(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是___,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是___(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
①对比实验4和5,可以获得的结论是___.
②用离子方程式解释实验6的现象:___.
| 实验及试剂 | 编号 | 无色NaClO3 溶液用量 | 试管中 溶液颜色 | 淀粉KI 试纸颜色 |
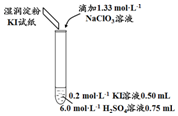 | 1 | 0.05 mL | 浅黄色 | 无色 |
| 2 | 0.20 mL | 深黄色 | 无色 | |
| 3 | 0.25 mL | 浅黄色 | 蓝色 | |
| 4 | 0.30 mL | 无色 | 蓝色 |

经检验,上述白色沉淀是AgCl.写出加入0.20mL NaClO3后,溶液中ClO3-和I-发生反应的离子方程式:___.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)
中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图实验,进一步佐证其中含有IO3-.

其中试剂X可以是___(填字母序号).
a.碘水b.KMnO4溶液c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是___,进一步佐证实验4中生成了Cl2.获得结论:NaClO3溶液用量增加导致溶液褪色的原因是___(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
| 编号 | 6.0 mol•L-1 H2SO4溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25 mL | 浅黄色 | 无色 |
| 6 | 0.85 mL | 无色 | 蓝色 |
②用离子方程式解释实验6的现象:___.
▼优质解答
答案和解析
(1)加入0.20mL NaClO3后,溶液颜色变为深黄色,淀粉KI试纸颜色变蓝色,说明氯酸根离子具有氧化性能氧化碘离子为单质碘,反应的离子方程式为:ClO3-+6I-+6H+═Cl-+3I2+3H2O,
故答案为:ClO3-+6I-+6H+═Cl-+3I2+3H2O;
(2)①取少量实验4中的无色溶液进行如图实验,无色溶液中加入试剂X变为黄色,加入四氯化碳萃取得到下层紫红色,说明生成了碘单质,加入的试剂具有还原性,能和碘酸根离子发生氧化还原反应生成碘单质,选择c选项的NaHSO3溶液,a选项含碘单质不能验证,b为高锰酸钾溶液具有氧化性,不符合要求,进一步佐证其中含有IO3-,所选试剂为c,
故答案为:c;
②将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化,说明无碘单质生成,排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2;说明是氯气的氧化性以后碘离子生成了碘单质;NaClO3溶液用量增加导致溶液褪色的原因是氯酸根离子以后碘单质为碘酸根离子,反应的离子方程式为:2ClO3-+I2═Cl2↑+2IO3-,
故答案为:排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰;2ClO3-+I2═Cl2↑+2IO3-;
(3)①对比实验5和6,硫酸用量不同试管中溶液颜色不同说明氢离子浓度不同氯酸根离子以后碘离子产物不同,获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关,
故答案为:ClO3-和I-的反应规律与H+(或H2SO4)的用量有关;
②实验6的现象是氯酸根离子以后碘离子生成碘酸根,通式生成氯气能使湿润的淀粉KI试纸变蓝色,反应的离子方程式为:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O,
故答案为:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
故答案为:ClO3-+6I-+6H+═Cl-+3I2+3H2O;
(2)①取少量实验4中的无色溶液进行如图实验,无色溶液中加入试剂X变为黄色,加入四氯化碳萃取得到下层紫红色,说明生成了碘单质,加入的试剂具有还原性,能和碘酸根离子发生氧化还原反应生成碘单质,选择c选项的NaHSO3溶液,a选项含碘单质不能验证,b为高锰酸钾溶液具有氧化性,不符合要求,进一步佐证其中含有IO3-,所选试剂为c,
故答案为:c;
②将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL 1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化,说明无碘单质生成,排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰,NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2;说明是氯气的氧化性以后碘离子生成了碘单质;NaClO3溶液用量增加导致溶液褪色的原因是氯酸根离子以后碘单质为碘酸根离子,反应的离子方程式为:2ClO3-+I2═Cl2↑+2IO3-,
故答案为:排除易升华的I2对湿润淀粉KI试纸检验Cl2的干扰;2ClO3-+I2═Cl2↑+2IO3-;
(3)①对比实验5和6,硫酸用量不同试管中溶液颜色不同说明氢离子浓度不同氯酸根离子以后碘离子产物不同,获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关,
故答案为:ClO3-和I-的反应规律与H+(或H2SO4)的用量有关;
②实验6的现象是氯酸根离子以后碘离子生成碘酸根,通式生成氯气能使湿润的淀粉KI试纸变蓝色,反应的离子方程式为:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O,
故答案为:6ClO3-+5I-+6H+═3Cl2↑+5IO3-+3H2O.
看了某实验小组同学模拟工业制碘的方...的网友还看了以下:
有100g10%的食盐溶液使其质量分数变为20%有三种方法填空与质量分数大于20%的浓食盐溶液混合与 2020-03-31 …
下列有关溶液配制的叙述正确的是()A.将58.5gNaCl溶于1L水中可得1L1.00mol•L- 2020-04-12 …
常温下,0.1mol•L-1的HA溶液中c(OH-)/c(H+)=1×10-8,下列叙述中正确的是 2020-05-13 …
有一支50毫升滴定管,其中盛有溶液,液面恰好在10毫升处,吧滴定管的溶液全部流下排出,承接在量筒中 2020-05-17 …
已知黄棕色的三氯化铁溶液呈酸性,且能与铁粉反应:2FeCl3+Fe==3FeCl2.现有一同学取一 2020-05-17 …
实验①:向盛有0.1mol/LAgNO3溶液的试管中滴加0.1mol/L的NaCl溶液至不再有白色 2020-05-17 …
PbCl2在相同浓度NaCl溶液和HCl溶液中的溶解现象差异我们普化实验课上做的是向等量的PbCl2 2020-12-14 …
下列关于溶液的说法中,正确的是()A.均一、稳定的液体一定是溶液B.饱和溶液一定比不饱和溶液浓度大C 2020-12-20 …
常温时,下列各组溶液中,水的电离的c(H+)相等的是()A.0.3mol/L的HCl溶液与0.3mo 2021-02-01 …
下列各组中的物质混合,形成溶液的质量比反应前溶液的总质量减少的是()A.铁和稀硫酸B.氢氧化钾溶液中 2021-02-18 …