早教吧作业答案频道 -->化学-->
我国市售加碘食盐中含有碘酸钾.已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.工业生产碘酸钾的流程如下:请回答下列问题:(1)已知反应室
题目详情
我国市售加碘食盐中含有碘酸钾.已知碘酸钾在酸性条件下是一种较强的氧化剂,可与碘化物、亚硫酸盐等还原性物质反应.工业生产碘酸钾的流程如下:
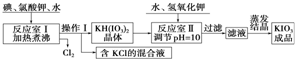
请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式:___.
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②___
(请从化学平衡角度解释).
(3)已知几种物质的溶解度见下表:
由上表数据分析可知,操作Ⅰ的名称为___、___.
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是___.
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0mol•L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00mL,则成品中KIO3的质量分数为___(列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,I2+2Na2S2O3═2NaI+Na2S4O6).
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
①请推测实验中产生蓝色现象的可能原因,用离子方程式表示___.
②根据乙同学的实验结果推测,甲同学的实验结果会___(填“偏大”,“偏小”或“无影响”).

请回答下列问题:
(1)已知反应室Ⅰ发生的反应中,两种还原产物所得电子数相同,请写出该反应的化学方程式:___.
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应:②___
(请从化学平衡角度解释).
(3)已知几种物质的溶解度见下表:
| KCl | KH(IO3)2 | KClO3 | |
| 溶解度g/100g水(25℃) | 20.8 | 0.8 | 7.5 |
| 溶解度g/100g水(80℃) | 37.1 | 12.4 | 16.2 |
(4)在反应室Ⅱ中加入KOH调节溶液的pH=10,其目的是___.
(5)甲同学欲测定成品中碘酸钾的含量,设计了如下实验:
①准确称取1g样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化上述所得溶液,加入过量KI溶液,充分搅拌;
③以淀粉为指示剂,逐滴加入2.0mol•L-1的Na2S2O3溶液,当蓝色刚好褪去时,消耗Na2S2O3溶液12.00mL,则成品中KIO3的质量分数为___(列式计算,结果保留三位有效数字)
(已知:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,I2+2Na2S2O3═2NaI+Na2S4O6).
(6)乙同学又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液. | 溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1mol/L KI溶液,振荡. | 溶液无变化 |
| 然后再滴入1滴1mol/L的H2SO4,振荡. | 溶液变蓝色 |
②根据乙同学的实验结果推测,甲同学的实验结果会___(填“偏大”,“偏小”或“无影响”).
▼优质解答
答案和解析
(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯元素守恒可知KClO3系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,故方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑,
故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应除去反应生成的氯气,有利于反应正反应方向进行,
故答案为:除去反应生成的氯气,有利于反应正反应方向进行;
(3)表数据分析可知KH(IO3)2在常温下溶解度小,操作Ⅰ是得到KH(IO3)2晶体,操作的名称为:冷却结晶,过滤得到晶体,
故答案为:冷却结晶,过滤;
(4)KH(IO3)2在碱性条件下可以转化成KHIO3,所以步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3,由于KIO3的溶解度受温度的影响较大且分解温度较高,所以采取蒸发结晶的方法,
故答案为:使KH(IO3)2转化为KIO3;
(5)设碘酸钾的物质的量为x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O3 2-=2I-+S4 O62-②,将方程式②×3+①得
IO3+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0mol/L×0.012L
x=0.004mol,碘酸钾的质量=0.004mol×214g/mol=0.856g,所以碘酸钾的质量分数=
×100%=85.6%,
故答案为:85.6%;
(6)酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O;
且酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,
故答案为:4I-+4H++O2=2I2+2H2O;偏大;
故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)反应室Ⅰ需加热煮沸,其目的是:①加快反应速率,使反应物充分反应除去反应生成的氯气,有利于反应正反应方向进行,
故答案为:除去反应生成的氯气,有利于反应正反应方向进行;
(3)表数据分析可知KH(IO3)2在常温下溶解度小,操作Ⅰ是得到KH(IO3)2晶体,操作的名称为:冷却结晶,过滤得到晶体,
故答案为:冷却结晶,过滤;
(4)KH(IO3)2在碱性条件下可以转化成KHIO3,所以步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3,由于KIO3的溶解度受温度的影响较大且分解温度较高,所以采取蒸发结晶的方法,
故答案为:使KH(IO3)2转化为KIO3;
(5)设碘酸钾的物质的量为x.
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O①; I2+2S2O3 2-=2I-+S4 O62-②,将方程式②×3+①得
IO3+6H++6S2O32-=I-+3S4O62-+3H2O
1 6
x 2.0mol/L×0.012L
x=0.004mol,碘酸钾的质量=0.004mol×214g/mol=0.856g,所以碘酸钾的质量分数=
| 0.856g |
| 1g |
故答案为:85.6%;
(6)酸性条件下,碘离子被氧气氧化生成碘单质,离子反应方程式为:4I-+4H++O2=2I2+2H2O;
且酸性条件下,过量的碘离子易被空气中氧气氧化生成碘单质,导致测定结果偏大,
故答案为:4I-+4H++O2=2I2+2H2O;偏大;
看了我国市售加碘食盐中含有碘酸钾....的网友还看了以下:
我国古代有“百里不贩柴,千里不贩米’’的说法,意思是指薪柴贩运的距离较小,粮食贩运距离较大。薪柴贩 2020-04-06 …
世界卫生组织最近把铝确定为食品污染源之一,加以控制使用.铝在下列应用时应加以控制的是()①制铝合金 2020-05-15 …
世界卫生组织最近把铝确定为食品污染源之一,加以控制使用.铝在下列应用时应加以控制的是()①制铝合金 2020-05-15 …
某人一到傍晚就看不清物体,医生给他诊断为夜盲症.该患者应多吃()A.含维生素D较多的食物B.含维生 2020-06-22 …
若平行四边形的两邻边长分别为16和20,两条较长边之间的距离分别为8,求两条较短若平行四边形的两邻 2020-07-30 …
判定四边形相似有什么条件?应该不需要每个角对应相等,每组边对应成比例吧?应该可以用较少的条件的吧? 2020-07-31 …
食品安全法第二十七条八题食品生产经营人员应当保持个人卫生,生产经营食品时,应当将手洗净,穿戴清洁的工 2020-11-04 …
现象,打磨后镁条呈,有,容易被弯曲,折断.结论,镁是一种色,有,质软的金属.还有一题。镁条放入食醋中 2020-12-19 …
天然橡胶树喜高温、高湿,根系浅,枝条较脆弱,对风的适应能力较差,易受风寒而降低产胶量,读图分析图中天 2020-12-25 …
国家级救灾物资储备基地的选址条件应该有()①地势较高,地质条件较好②交通运输便利③市政条件较好④靠近 2020-12-30 …