早教吧作业答案频道 -->化学-->
原子结构与元素周期表存在着内在联系.根据所学物质结构知识,请你回答下列问题:(1)请按要求任意写一个相应物质(填化学式):含有非极性键的离子化合物,既含有非极性键的又
题目详情
原子结构与元素周期表存在着内在联系.根据所学物质结构知识,请你回答下列问题:
(1)请按要求任意写一个相应物质(填化学式):含有非极性键的离子化合物___,既含有非极性键的又含极性的非极性分子___,既含有非极性键的又含极性键的极性分子___,全部由非金属组成的离子化合物___,由金属和非金属组成的共价化合物___.
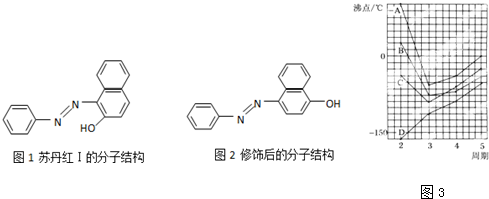
(2)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康.苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4种类型,苏丹红Ⅰ号的分子结构如图1所示.苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示的结构,则其在水中的溶解度会___(填“增大”或“减小”),原因是___.
(3)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色.两种晶体的组成皆为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
.
绿色晶体配合物的化学式为___,由Cl所形成的化学键类型是___.
(4)图3中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是___;表示ⅣA族元素氢化物沸点的曲线是___;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是___;A、B、C曲线中第二周期元素的氢化物的沸点显著高于第三周期元素的氢化物的沸点,其原因是___.

(1)请按要求任意写一个相应物质(填化学式):含有非极性键的离子化合物___,既含有非极性键的又含极性的非极性分子___,既含有非极性键的又含极性键的极性分子___,全部由非金属组成的离子化合物___,由金属和非金属组成的共价化合物___.
(2)苏丹红颜色鲜艳、价格低廉,常被一些企业非法作为食品和化妆品等的染色剂,严重危害人们健康.苏丹红常见有Ⅰ、Ⅱ、Ⅲ、Ⅳ4种类型,苏丹红Ⅰ号的分子结构如图1所示.苏丹红Ⅰ在水中的溶解度很小,微溶于乙醇,有人把羟基取代在对位形成图2所示的结构,则其在水中的溶解度会___(填“增大”或“减小”),原因是___.
(3)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色.两种晶体的组成皆为TiCl3•6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
绿色晶体配合物的化学式为___,由Cl所形成的化学键类型是___.
(4)图3中A、B、C、D四条曲线分别表示第ⅣA、ⅤA、ⅥA、ⅦA族元素的氢化物的沸点,其中表示ⅦA族元素氢化物沸点的曲线是___;表示ⅣA族元素氢化物沸点的曲线是___;同一族中第3、4、5周期元素的氢化物沸点依次升高,其原因是___;A、B、C曲线中第二周期元素的氢化物的沸点显著高于第三周期元素的氢化物的沸点,其原因是___.
▼优质解答
答案和解析
(1)含有非极性键的离子化合物为Na2O2等,既含有非极性键的又含极性的非极性分子为C2H2等,既含有非极性键的又含极性键的极性分子有H2O2等,全部由非金属组成的离子化合物为NH4NO3等,由金属和非金属组成的共价化合物有AlCl3等,
故答案为:Na2O2;C2H2;H2O2;NH4NO3;AlCl3;
(2)因为苏丹红Ⅰ易形成分子内氢键而使在水中的溶解度很小,微溶于乙醇,而修饰后的结构易形成分子间氢键,与水分子形成氢键后有利于的增大在水中的溶解度,
故答案为:增大;苏丹红Ⅰ易形成分子内氢键而使在水中的溶解度很小,而修饰后的结构易形成分子间氢键,与水分子形成氢键后有利于的增大在水中的溶解度;
(3)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
,可知紫色晶体中含3个氯离子,绿色晶体中含2个氯离子,即绿色晶体的化学式为[TiCl(H2O)5]Cl2•H2O,氯原子形成化学键有含有离子键、配位键,
故答案为:[TiCl(H2O)5]Cl2•H2O;离子键、配位键;
(4)第二周期中元素形成的氢化物中水为液态,其它为气体,故水的沸点最高,其且相对分子质量越大,沸点越高,故B曲线为ⅦA族元素氢化物沸点;
HF分子之间、氨气分子之间均存在氢键,沸点高于同主族相邻元素氢化物,甲烷分子之间不能形成氢键,同主族形成的氢化物中沸点最低,故D曲线表示ⅣA族元素氢化物沸点;
同一族中第3、4、5周期元素的氢化物结构与组成相似,分子之间不能形成氢键,相对分子质量越大,分子间作用力越大,沸点越高;水分子之间、氨气分子之间、HF分子之间均形成氢键,沸点较高,
故答案为:B;D;结构与组成相似,分子之间不能形成氢键,相对分子质量越大,分子间作用力越大,沸点越高;水分子之间、氨气分子之间、HF分子之间均形成氢键,沸点较高.
故答案为:Na2O2;C2H2;H2O2;NH4NO3;AlCl3;
(2)因为苏丹红Ⅰ易形成分子内氢键而使在水中的溶解度很小,微溶于乙醇,而修饰后的结构易形成分子间氢键,与水分子形成氢键后有利于的增大在水中的溶解度,
故答案为:增大;苏丹红Ⅰ易形成分子内氢键而使在水中的溶解度很小,而修饰后的结构易形成分子间氢键,与水分子形成氢键后有利于的增大在水中的溶解度;
(3)Ti3+的配位数均为6,往待测溶液中滴入AgNO3溶液,均产生白色沉淀,则有氯离子在配合物的外界,两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
故答案为:[TiCl(H2O)5]Cl2•H2O;离子键、配位键;
(4)第二周期中元素形成的氢化物中水为液态,其它为气体,故水的沸点最高,其且相对分子质量越大,沸点越高,故B曲线为ⅦA族元素氢化物沸点;
HF分子之间、氨气分子之间均存在氢键,沸点高于同主族相邻元素氢化物,甲烷分子之间不能形成氢键,同主族形成的氢化物中沸点最低,故D曲线表示ⅣA族元素氢化物沸点;
同一族中第3、4、5周期元素的氢化物结构与组成相似,分子之间不能形成氢键,相对分子质量越大,分子间作用力越大,沸点越高;水分子之间、氨气分子之间、HF分子之间均形成氢键,沸点较高,
故答案为:B;D;结构与组成相似,分子之间不能形成氢键,相对分子质量越大,分子间作用力越大,沸点越高;水分子之间、氨气分子之间、HF分子之间均形成氢键,沸点较高.
看了原子结构与元素周期表存在着内在...的网友还看了以下:
下列有关分子结构与性质的叙述中正确的是()A.CS2、H2O、C2H2都是直线形分子B.非极性键只 2020-05-14 …
下列有关分子结构与性质的叙述中正确的是()A.CS2、H2O、C2H2都是直线形分子B.CH4、C 2020-05-14 …
谁有人教版七年级下英语课时训练unit1~6(当然是一单元的那个,不是6单元)或期中复习或第七单元 2020-06-05 …
学校职工宿舍楼共有6层5个单元,每个单元每层楼都有2户人家,如果给每户人家编上门牌号码,从门牌号码 2020-06-06 …
楼有6层,5个单元,每个单元每层都有2户人家,请给每户人家编上门牌号码,从编号中要能看出这户人家是 2020-06-06 …
学校职工宿舍楼公有6层5个单元,每个单元每层楼都有两户人家,如果给每户人家编上门牌号,从门牌号码中 2020-06-06 …
某商场将进价为40元的一个某种商品按50元销出时,能卖出500个想用提高销价提高利润,每长1元少买 2020-06-26 …
下面那种证券具有较高实际年利率?(1)票面金额100000元,售价97645元的3个月期限的国库券 2020-06-27 …
超市搞促销活动,购物满100元送20元礼券(可用于再次购物),李老师买了300元的一个提包,用得到 2020-06-30 …
超市搞促销活动,购物满100元送20元礼券(可用于再次购物),李老师买了300元的一个提包,用得到 2020-07-10 …