早教吧作业答案频道 -->化学-->
氯化铁和高铁酸钾都是常见的水处理剂,如图为制备粗高铁酸钾的工业流程.请回答下列问题:(1)氯化铁做净水剂的原因是(结合化学用语表达).(2)吸收剂X的化学式为,氧化剂Y
题目详情
氯化铁和高铁酸钾都是常见的水处理剂,如图为制备粗高铁酸钾的工业流程.
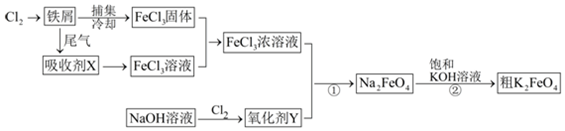
请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达)___.
(2)吸收剂X的化学式为___,氧化剂Y的化学式为___.
(3)碱性条件下反应①的离子方程式为___.
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品.该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因___.
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___(填序号).
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是___.
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点.以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式___.

请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达)___.
(2)吸收剂X的化学式为___,氧化剂Y的化学式为___.
(3)碱性条件下反应①的离子方程式为___.
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品.该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因___.
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用___(填序号).
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是___.
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点.以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式___.
▼优质解答
答案和解析
(1)氯化铁做净水剂是因为Fe3+水解为Fe(OH)3胶体的缘故,原理为Fe3++3H2O⇌Fe(OH)3(胶体)+3H+,Fe(OH)3胶体能够吸附杂质;
故答案为:Fe3++3H2O⇌Fe(OH)3+3H+,水解产生的Fe(OH)3胶体能够吸附杂质;
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2;Cl2与氢氧化钠反应生成NaClO和NaCl,其中NaClO能做氧化剂,所以Y为NaClO,
故答案为:FeCl2;NaClO;
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(4)该反应的化学方程式为2KOH+Na2FeO4 =K2FeO4+2NaOH,反应能发生的原因是K2FeO4溶解度小,析出晶体,促进反应进行;
答案为:K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行;
(5)K2FeO4 在水溶液中易发生反应:4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑,所以用碱液来洗涤,抑制水解,不引入新的杂质所以用稀KOH溶液,高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率;
故答案为:B;高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率;
(6)以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,高铁酸根离子得到电子生成铁离子,用传导离子硫酸根离子配平电极反应,该电池正极电极反应式:FeO42-3e-+4SO3═Fe3++4SO42-;
故答案为:FeO42-3e-+4SO3═Fe3++4SO42-.
故答案为:Fe3++3H2O⇌Fe(OH)3+3H+,水解产生的Fe(OH)3胶体能够吸附杂质;
(2)吸收剂X的与Cl2反应的产物是FeCl3,X是FeCl2;Cl2与氢氧化钠反应生成NaClO和NaCl,其中NaClO能做氧化剂,所以Y为NaClO,
故答案为:FeCl2;NaClO;
(3)碱性条件下根据反应物和产物可知,反应①的离子方程式为3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
故答案为:3ClO-+2Fe3++10OH-=2FeO42-+3Cl-+5H2O;
(4)该反应的化学方程式为2KOH+Na2FeO4 =K2FeO4+2NaOH,反应能发生的原因是K2FeO4溶解度小,析出晶体,促进反应进行;
答案为:K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行;
(5)K2FeO4 在水溶液中易发生反应:4FeO42-+10H2O═4Fe(OH)3+8OH-+3O2↑,所以用碱液来洗涤,抑制水解,不引入新的杂质所以用稀KOH溶液,高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率;
故答案为:B;高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率;
(6)以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,高铁酸根离子得到电子生成铁离子,用传导离子硫酸根离子配平电极反应,该电池正极电极反应式:FeO42-3e-+4SO3═Fe3++4SO42-;
故答案为:FeO42-3e-+4SO3═Fe3++4SO42-.
看了氯化铁和高铁酸钾都是常见的水处...的网友还看了以下:
1.分解因式的理论依据是什么?2.(x-1)^2-25=0用分解因式法(过程)3.若多项式x^2+ 2020-05-17 …
物理方程在列出以后依据条件进行化简运算的时候,等式中的各个部分是否还具有物理意义?具体来说,就以弦 2020-08-02 …
行列式按行(列)展开定理的证明定理3行列式等于它的任一行(列)的各元素与其对应的代数余子式乘积之和 2020-08-03 …
修理厂在一个月中修理了40辆车,包括汽车和轻便摩托车,修理好的车轮恰好是100个,汽车,摩托车各修了 2020-11-21 …
如图为碳元素在生态系统中循环的模式图,图中甲、乙、丙表示生态系统的生物成分,箭头表示生理过程.下列相 2020-11-22 …
下列对学习方式的理解正确的有[]①好的学习方式不是天生的,需要在摸索尝试的过程中寻找②中学时代,我们 2020-12-09 …
化学反应方程式的理解注重反应过程的研究.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂 2020-12-18 …
一位理财专家给出这样一个投资理财公式:“理财方程式=50%稳守+25%稳攻+25%强攻”。这一理财公 2020-12-18 …
一位理财专家给出这样一个投资理财公式:“理财方程式=50%稳守+25%稳攻+25%强攻”。这一理财公 2020-12-20 …
请教一道数学题,答出列式和理由就可以了,谢谢.一辆汽车往返甲乙两地公用8小时,去时每小时行驶35千米 2020-12-24 …