早教吧作业答案频道 -->化学-->
美国麻省理工学院(MIT)近年来设计出镁锑液态金属电池,其工作原理如图1所示,负极金属失去电子,并通过外电路做功,而负极金属离子化后通过熔盐迁移到正极并与正极金属合金化;充
题目详情
美国麻省理工学院(MIT)近年来设计出镁锑液态金属电池,其工作原理如图1所示,负极金属失去电子,并通过外电路做功,而负极金属离子化后通过熔盐迁移到正极并与正极金属合金化;充电则执行相反的过程.
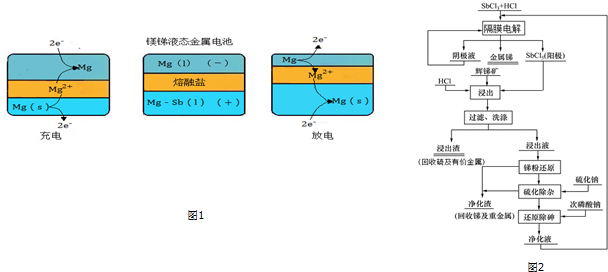
(1)写出电池放电时的正极反应式为___.
(2)我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组进行三氯化锑水溶液的电解研究,然后利用电解过程中阳极生成的五氯化锑作为浸出剂,对辉锑矿进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图2:
①写出锑元素在周期表中的位 置___.
②“工业三废”指的是___.
③电解过程中阳极主要是Sb3+被氧化成Sb5+.请写出阴极的电极反应式___.
④根据流程图写出“浸出”步骤发生反应的化学方程式___.
⑤已知浸出液中除Sb3+外,还有Cu2+、Pb2+等重金属离子,其中c(Cu2+)=1.6×10-3mol•L-1,向浸出液中加入硫化钠至溶液中的Cu2+刚好完全沉淀,则c(S2-)=___.(已知Ksp(CuS)=8×10-45 Ksp(PbS)=3.4×10-28)
⑥还原除砷的原理是:在大于4mol•L-1的HCl溶液中,以次磷酸钠(Na3PO2)做还原剂,保持微沸温度,使AsCl3被还原为棕色单质砷沉淀,请配平该反应的化学方程式:
___AsCl3+___Na3PO2+___HCl+___H2O=___As↓+___H3PO3+___NaCl.

(1)写出电池放电时的正极反应式为___.
(2)我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物.某冶金课题组进行三氯化锑水溶液的电解研究,然后利用电解过程中阳极生成的五氯化锑作为浸出剂,对辉锑矿进行酸性浸出;从而实现浸出-电解的闭路循环,解决了传统炼锑过程中“工业三废”排放量大的问题.流程如图2:
①写出锑元素在周期表中的位 置___.
②“工业三废”指的是___.
③电解过程中阳极主要是Sb3+被氧化成Sb5+.请写出阴极的电极反应式___.
④根据流程图写出“浸出”步骤发生反应的化学方程式___.
⑤已知浸出液中除Sb3+外,还有Cu2+、Pb2+等重金属离子,其中c(Cu2+)=1.6×10-3mol•L-1,向浸出液中加入硫化钠至溶液中的Cu2+刚好完全沉淀,则c(S2-)=___.(已知Ksp(CuS)=8×10-45 Ksp(PbS)=3.4×10-28)
⑥还原除砷的原理是:在大于4mol•L-1的HCl溶液中,以次磷酸钠(Na3PO2)做还原剂,保持微沸温度,使AsCl3被还原为棕色单质砷沉淀,请配平该反应的化学方程式:
___AsCl3+___Na3PO2+___HCl+___H2O=___As↓+___H3PO3+___NaCl.
▼优质解答
答案和解析
(1)负极失电子生成的金属离子在正极得电子生成金属单质,负极金属为镁,故正极电极反应式为Mg2++2e-=Mg;
故答案为:Mg2++2e-=Mg;
(2)①锑元素属于氮族元素,位于周期表中第五周期第ⅤA族;
故答案为:第五周期第VA族;
②工业三废包括废气、废水(废液)、废渣;
故答案为:废气、废水(废液)、废渣;
③从流程图中可以看出阳极产物为SbCl5,而电解完成后产生金属锑,故阴极反应式为Sb3++3e-=Sb;
故答案为:Sb3++3e-=Sb;
④在浸出步骤中具有氧化性的SbCl5和具有还原性的Sb2S3发生氧化还原反应生成不溶性的S单质和SbCl3,故反应方程式为Sb2S3+3SbCl5=5SbCl3+3S;
故答案为:Sb2S3+3SbCl5=5SbCl3+3S;
⑤Cu2+刚好完全沉淀时c(Cu2+)=1×10-5,由Ksp(CuS)=c(Cu2+)×c(S2-),知c(S2-)=
=
=8×10-40;
故答案为:8×10-40;
⑥次磷酸钠(Na3PO2)做还原剂,被氧化为H3PO3,P元素由+1价变为+3价,价态升高2;AsCl3被还原为As单质,As元素由+3价变为0价,价态降低3,所以AsCl3和Na3PO2系数为2:3,根据元素守恒配平化学反应方程式为2AsCl3+3Na3PO2+3HCl+3H2O=2As↓+3H3PO3+9NaCl.
故答案为:2;3;3;3;2;3;9.
故答案为:Mg2++2e-=Mg;
(2)①锑元素属于氮族元素,位于周期表中第五周期第ⅤA族;
故答案为:第五周期第VA族;
②工业三废包括废气、废水(废液)、废渣;
故答案为:废气、废水(废液)、废渣;
③从流程图中可以看出阳极产物为SbCl5,而电解完成后产生金属锑,故阴极反应式为Sb3++3e-=Sb;
故答案为:Sb3++3e-=Sb;
④在浸出步骤中具有氧化性的SbCl5和具有还原性的Sb2S3发生氧化还原反应生成不溶性的S单质和SbCl3,故反应方程式为Sb2S3+3SbCl5=5SbCl3+3S;
故答案为:Sb2S3+3SbCl5=5SbCl3+3S;
⑤Cu2+刚好完全沉淀时c(Cu2+)=1×10-5,由Ksp(CuS)=c(Cu2+)×c(S2-),知c(S2-)=
| Ksp(CuS) |
| c(S 2-) |
| 8×10 -45 |
| 1×10 -5 |
故答案为:8×10-40;
⑥次磷酸钠(Na3PO2)做还原剂,被氧化为H3PO3,P元素由+1价变为+3价,价态升高2;AsCl3被还原为As单质,As元素由+3价变为0价,价态降低3,所以AsCl3和Na3PO2系数为2:3,根据元素守恒配平化学反应方程式为2AsCl3+3Na3PO2+3HCl+3H2O=2As↓+3H3PO3+9NaCl.
故答案为:2;3;3;3;2;3;9.
看了美国麻省理工学院(MIT)近年...的网友还看了以下:
下列叙述中,不正确的是()A.原电池是将化学能转化为电能的装置B.轮船底部镶嵌锌块,锌作负极,以防 2020-05-13 …
电解水的实验中,在水中加入少量的稀硫酸的目的是,正极得到气,负极得到气,正负两极气体的体积比是,电 2020-05-13 …
如图所示,平行金属带电极板MN间为匀强电场,N板接地,两板间距为10cm.将电量为4×10-6C的 2020-07-08 …
图为原电池的示意图.请回答:(1)Zn极为原电池的(填“正”或“负”)极,该极的电极反应式是,属于 2020-07-12 …
血清蛋白质的电泳分离时,点样端置于电场的正极还是负极?为什么?在本实验电泳过程中,正负电极各发生什 2020-07-29 …
下列有关原电池的说法中正确的是()A.在原电池中一定是相对较活泼的金属做负极不活泼的金属做正极B. 2020-07-29 …
下列叙述中正确的是()A.原电池的负极得到电子,发生还原反应B.原电池中较活泼的金属作正极C.原电池 2020-12-26 …
下列说法正确的是.()A.不管是原电池还是电解池,阳离子总是向发生还原反应的电极移动B.在原电池中, 2020-12-26 …
(2012•东城区模拟)某小组根据工业生产原理设计如下转化关系,以获取烧碱和金属钛(Ti).(1)燃 2021-01-24 …
如图所示,试回答下列问题:(1)电解质溶液为稀H2SO4时,则负电极为,负极电极反应式.(2)电解质 2021-01-24 …