早教吧作业答案频道 -->化学-->
氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi):(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3.①已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1N2(g)+O2(
题目详情
氮族元素包括氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi):
(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3.
①已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1
N2(g)+O2(g)⇌2NO(g)△H=+180kJ•mol-1
H2(g)+
O2(g)⇌H2O(l)△H=-285.8kJ•mol-1
则4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=___.
②现将1mol N2(g)、3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,下列说法中正确的是___.
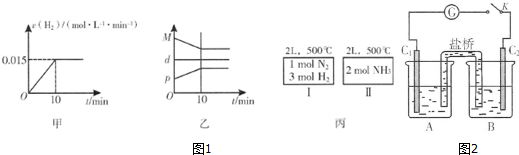
A.图1甲为用H2表示的反应速率变化曲线
B.图1乙表示反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p的变化情况
C.图1丙的两个容器中分别发生反应:N2(g)+3H2(g)⇌2NH3(g)、2NH3(g)⇌N2(g)+3H2(g).达到化学平衡时,相同组分的浓度相等且两个反应的平衡常数互为倒数
(2)反应PCl5(g)⇌PCl3(g)+Cl2(g)△H>0,在2L密闭容器中放人1molPCl5,保持一段时间后达到平衡.反应过程中测定的部分数据见下表:
①若改变温度使v(逆)增大,平衡___移动(填“正向”、“逆向”或“不”);
②该温度下,该反应的平衡常数为___.
(3)①推断As元素在周期表中的位置是___.
②已知某砷酸盐可发生如下反应:AsO43-+2I-+2H+⇌AsO33-+I2+H2O.某化学兴趣小组利用该反应原理设计如图2所示装置:C1、C2是石墨电极,A中盛有KI和I2混合溶液,B中盛有Na3AsO4和Na3AsO3的混合溶液,当连接开关K后,A中溶液颜色逐渐变深,灵敏电流计G的指针向右偏转.此时C2上发生的电极反应式是___;一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针___(填“不动”、“向左偏”或“向右偏”).
(1)氮是地球上含量丰富的一种元素,工业上用N2和H2合成NH3.
①已知:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1
N2(g)+O2(g)⇌2NO(g)△H=+180kJ•mol-1
H2(g)+
| 1 |
| 2 |
则4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H=___.
②现将1mol N2(g)、3mol H2(g)充入一容积为2L的密闭容器中,在500℃下进行反应,10min时达到平衡,下列说法中正确的是___.

A.图1甲为用H2表示的反应速率变化曲线
B.图1乙表示反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为p的变化情况
C.图1丙的两个容器中分别发生反应:N2(g)+3H2(g)⇌2NH3(g)、2NH3(g)⇌N2(g)+3H2(g).达到化学平衡时,相同组分的浓度相等且两个反应的平衡常数互为倒数
(2)反应PCl5(g)⇌PCl3(g)+Cl2(g)△H>0,在2L密闭容器中放人1molPCl5,保持一段时间后达到平衡.反应过程中测定的部分数据见下表:
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
②该温度下,该反应的平衡常数为___.
(3)①推断As元素在周期表中的位置是___.
②已知某砷酸盐可发生如下反应:AsO43-+2I-+2H+⇌AsO33-+I2+H2O.某化学兴趣小组利用该反应原理设计如图2所示装置:C1、C2是石墨电极,A中盛有KI和I2混合溶液,B中盛有Na3AsO4和Na3AsO3的混合溶液,当连接开关K后,A中溶液颜色逐渐变深,灵敏电流计G的指针向右偏转.此时C2上发生的电极反应式是___;一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针___(填“不动”、“向左偏”或“向右偏”).
▼优质解答
答案和解析
(1)①已知:Ⅰ.N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ•mol-1
Ⅱ.N2(g)+O2(g)⇌2NO(g)△H=+180kJ•mol-1
Ⅲ.H2(g)+
O2(g)⇌H2O(l)△H=-285.8kJ•mol-1
根据盖斯定律,Ⅲ×6+Ⅱ×2-Ⅰ×2可得:4NH3(g)+5O2(g)═4NO(g)+6H2O(l),△H=
6×(-285.8kJ•mol-1)+2×180kJ•mol-1-2×(-92.2kJ•mol-1)=-1170.4kJ•mol-1,
故答案为:-1170.4kJ•mol-1;
②A.用H2表示的反应速率为一段时间内平均速率,不是即时速率,而图甲中为即时速率,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体密度为定值,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,至平衡时不再变化,压强也随反应进行减小,至平衡时不再变化,故B错误;
C.丙的两个容器中温度均相同,分别发生反应:N2(g)+3H2(g)⇌2NH3(g)、2NH3(g)⇌N2(g)+3H2(g),两个反应的平衡常数互为倒数,且为完全等效平衡,平衡时相同组分的浓度相等,故C正确,
故选:C;
(2)①正反应为吸热反应,升高温度平衡向正反应移动,故答案为:正向;
②250s处于平衡状态,平衡时PCl3为0.2mol,则:
PCl5(g)⇌PCl3(g)+Cl2(g)
起始量(mol):1 0 0
变化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.2 0.2
平衡常数K=
=
=0.025,
故答案为:0.025;
(3)①As处于第四周期VA族,故答案为:第四周期VA族;
②B中滴加浓盐酸时发生AsO43-+2I-+2H+⇌AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为:AsO42-+2H++2e-=AsO32-+H2O,灵敏电流计G的指针向右偏转,说明指针偏向电流流入方向,向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-⇌AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,导线中电流由左向右,可观察到电流计指针向左偏,
故答案为:AsO42-+2H++2e-=AsO32-+H2O;向左偏.
Ⅱ.N2(g)+O2(g)⇌2NO(g)△H=+180kJ•mol-1
Ⅲ.H2(g)+
| 1 |
| 2 |
根据盖斯定律,Ⅲ×6+Ⅱ×2-Ⅰ×2可得:4NH3(g)+5O2(g)═4NO(g)+6H2O(l),△H=
6×(-285.8kJ•mol-1)+2×180kJ•mol-1-2×(-92.2kJ•mol-1)=-1170.4kJ•mol-1,
故答案为:-1170.4kJ•mol-1;
②A.用H2表示的反应速率为一段时间内平均速率,不是即时速率,而图甲中为即时速率,故A错误;
B.混合气体总质量不变,容器容积不变,混合气体密度为定值,随反应进行混合气体总物质的量减小,则平均相对分子质量减小,至平衡时不再变化,压强也随反应进行减小,至平衡时不再变化,故B错误;
C.丙的两个容器中温度均相同,分别发生反应:N2(g)+3H2(g)⇌2NH3(g)、2NH3(g)⇌N2(g)+3H2(g),两个反应的平衡常数互为倒数,且为完全等效平衡,平衡时相同组分的浓度相等,故C正确,
故选:C;
(2)①正反应为吸热反应,升高温度平衡向正反应移动,故答案为:正向;
②250s处于平衡状态,平衡时PCl3为0.2mol,则:
PCl5(g)⇌PCl3(g)+Cl2(g)
起始量(mol):1 0 0
变化量(mol):0.2 0.2 0.2
平衡量(mol):0.8 0.2 0.2
平衡常数K=
| c(PCl3)×c(Cl2) |
| c(PCl5) |
| ||||
|
故答案为:0.025;
(3)①As处于第四周期VA族,故答案为:第四周期VA族;
②B中滴加浓盐酸时发生AsO43-+2I-+2H+⇌AsO33-+I2+H2O,A中C1棒为负极,发生2I--2e-=I2,C2为正极发生还原反应,电极反应为:AsO42-+2H++2e-=AsO32-+H2O,灵敏电流计G的指针向右偏转,说明指针偏向电流流入方向,向B中滴加过量浓NaOH溶液,发生AsO33-+I2+2OH-⇌AsO43-+2I-+H2O,C2棒为负极,电子由负极流向正极,导线中电流由左向右,可观察到电流计指针向左偏,
故答案为:AsO42-+2H++2e-=AsO32-+H2O;向左偏.
看了氮族元素包括氮(N)、磷(P)...的网友还看了以下:
空气,氮气和氧气空气中氮气占五分之四,氧气占五分之一,氮气和氧气的最简单的整数比是多少?氧气与空气 2020-05-22 …
下列可以鉴定出分解尿素的细菌的方法是()A.以尿素为唯一氮源的培养基中加入酚红指示剂B.以尿素为唯 2020-06-26 …
图甲是从土壤中筛选产脲酶细菌的过程,图乙是脲酶基因转录的mRNA部分序列.(1)图中选择培养基应以 2020-06-26 …
在以尿素为惟一氮源的培养基中加入酚红指示剂的目的是A.对分离的菌种作进一步的鉴定B.筛选出能分解尿 2020-06-30 …
一氮化硼(BN)的一种晶体结构和金刚石相似,密度为3.52g.cm-3,求B-N的键长.我算出来了 2020-07-05 …
空气中的氧气体积约占五分之一,氮气体积约占五分之四.小明卧室的空间大约有35平方米,其中有氧气多少 2020-07-27 …
空气中的氧气体积约占五分之一,氮气体积约占五分之四.小明卧室的空间大约有35m³,其中有氧气多少立 2020-07-27 …
铋的化合物常用于医学,铋也常与铅、锡、镉、锑、铟等组成一系列低熔合金,可作防火装置、电器保险丝、锅炉 2020-11-01 …
下列可以鉴定出分解尿素的细菌的方法是()A.以尿素为唯一氮源的培养基中加入酚红指示剂B.以尿素为唯一 2020-11-03 …
在以尿素为唯一氮源的选择培养基上生长的全部是能够利用尿素的微生物么?在以尿素为唯一氮源的选择培养基上 2020-11-05 …