早教吧作业答案频道 -->化学-->
氮及其化合物在生活、生产和科技等方面有重要的应用.砷位于周期表中的第四周期,与氮元素属同一主族元素,其广泛分布与自然界.试回答下列问题:(1)砷的气态氢化物的电子式为
题目详情
氮及其化合物在生活、生产和科技等方面有重要的应用.砷位于周期表中的第四周期,与氮元素属同一主族元素,其广泛分布与自然界.试回答下列问题:
(1)砷的气态氢化物的电子式为___.
(2)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮做催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:___.
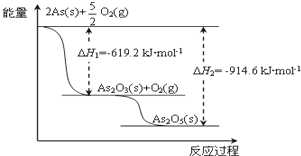
(3)砷的常见酸性氧化物有As2O3和As2O5,请根据图相关信息写出As2O5分解为As2O3的热化学方程式:___.
(4)直接供氨式碱性燃料电池的电池反应式为4NH2+3O2=2N2+6H2O,电解质溶液一般使用氢氧化钾溶液,则负极电极反应式为___.
(5)氨气和二氧化碳在120℃,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中氨气的含量变化关系如图所示,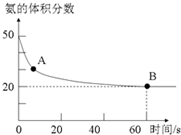 ,则氨气的平衡转化率是___.
,则氨气的平衡转化率是___.
(6)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s)⇌2NH3(g)+CO2(g),其分解达到平衡状态时,该反应的化学平衡常数的表达式为___.
(7)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)⇌2NO2(g)△H>0,该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是___(填序号)
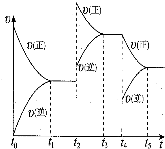
a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值.
(1)砷的气态氢化物的电子式为___.
(2)氨和联氨(N2H4)是氮的两种常见化合物,制备联氨可用丙酮做催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:___.
(3)砷的常见酸性氧化物有As2O3和As2O5,请根据图相关信息写出As2O5分解为As2O3的热化学方程式:___.

(4)直接供氨式碱性燃料电池的电池反应式为4NH2+3O2=2N2+6H2O,电解质溶液一般使用氢氧化钾溶液,则负极电极反应式为___.
(5)氨气和二氧化碳在120℃,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O(g),在密闭反应容器中,混合气体中氨气的含量变化关系如图所示,
 ,则氨气的平衡转化率是___.
,则氨气的平衡转化率是___.(6)将一定量的NH2COONH4(s)置于恒温密闭容器中,NH2COONH4(s)⇌2NH3(g)+CO2(g),其分解达到平衡状态时,该反应的化学平衡常数的表达式为___.
(7)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)⇌2NO2(g)△H>0,该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是___(填序号)

a.在t1-t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施可以是升高温度
c.在t3-t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t5时,容器内NO2的体积分数是整个过程中的最大值.
▼优质解答
答案和解析
(1)AsH3中As原子与H原子之间形成1对共用电子对,电子式为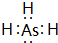 ,故答案为:
,故答案为: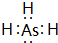 ;
;
(2)次氯酸钠与氨气反应生成N2H4,反应中N元素化合价升高,NH3为还原剂,则NaClO为氧化剂,反应中还原剂与氧化剂的物质的量之比为2:1,设Cl元素在还原产物中化合价为a,则2×[(-2)-(-3)]=1×(1-a),解得a=-1,故还原生成NaCl,由元素守恒可知有水生成,反应方程式为NaClO+2NH3=N2H4+NaCl+H2O,
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
(3)由图象可知,As2O5分解为As2O3需要吸收的热量,1molAs2O5分解的焓变△H=-619.2kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1;
(4)原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O;
(5)由图可知,开始时氨气体积分数为50%,则开始氨气与二氧化碳的物质的量相等,设氨气、二氧化碳均为1mol,设转化的氨气为xmol,由方程式CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O可知,平衡时混合气体减少物质的量等于氨气物质的量,故平衡时混合气体总物质的量为(2-x)mol,平衡时氨气为(1-x)mol,则
=20%,解得x=0.75,故氨气转化率为
×100%=75%,
故答案为:75%;
(6)可逆反应NH2COONH4(s)⇌2NH3(g)+CO2(g)的化学平衡常数的表达式K=c2(NH3)•c(CO2),故答案为:K=c2(NH3)•c(CO2);
(7)a.2NO(g)+O2(g)⇌2NO2(g)该反应是气体体积减小的反应,随反应进行混合气体物质的量减小,容器内气体压强减小,容器内气体的压强保持不变,说反应已达到平衡状态,故a正确;
b.在t2时,正逆反应速率都增大,且平衡正向移动,由于正反应为氢气体积减小的吸热反应,可能是升高温度,或增大压强,故b正确;
c.混合气体总质量不变,容器容积不变,混合气体的密度始终不变,故c错误;
d.t2时平衡正向移动,t4时减小了生成物浓度,平衡正向移动,反应物浓度相应减小,所以容器内NO2的体积分数在t3~t4时最大,故d错误,
故选:ab.
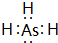 ,故答案为:
,故答案为: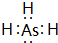 ;
;(2)次氯酸钠与氨气反应生成N2H4,反应中N元素化合价升高,NH3为还原剂,则NaClO为氧化剂,反应中还原剂与氧化剂的物质的量之比为2:1,设Cl元素在还原产物中化合价为a,则2×[(-2)-(-3)]=1×(1-a),解得a=-1,故还原生成NaCl,由元素守恒可知有水生成,反应方程式为NaClO+2NH3=N2H4+NaCl+H2O,
故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
(3)由图象可知,As2O5分解为As2O3需要吸收的热量,1molAs2O5分解的焓变△H=-619.2kJ/mol-(-914.6kJ/mol)=+295.4 kJ•mol-1,则热化学方程式As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1,
故答案为:As2O5(s)=As2O3(s)+O2(g)△H=+295.4 kJ•mol-1;
(4)原电池负极发生氧化反应,氨气在负极失去电子,碱性条件下生成氮气与水,负极电极反应式为2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O;
(5)由图可知,开始时氨气体积分数为50%,则开始氨气与二氧化碳的物质的量相等,设氨气、二氧化碳均为1mol,设转化的氨气为xmol,由方程式CO2(g)+2NH3(g)⇌(NH2)2CO(s)+H2O可知,平衡时混合气体减少物质的量等于氨气物质的量,故平衡时混合气体总物质的量为(2-x)mol,平衡时氨气为(1-x)mol,则
| (1-x)mol |
| (2-x)mol |
| 0.75mol |
| 1mol |
故答案为:75%;
(6)可逆反应NH2COONH4(s)⇌2NH3(g)+CO2(g)的化学平衡常数的表达式K=c2(NH3)•c(CO2),故答案为:K=c2(NH3)•c(CO2);
(7)a.2NO(g)+O2(g)⇌2NO2(g)该反应是气体体积减小的反应,随反应进行混合气体物质的量减小,容器内气体压强减小,容器内气体的压强保持不变,说反应已达到平衡状态,故a正确;
b.在t2时,正逆反应速率都增大,且平衡正向移动,由于正反应为氢气体积减小的吸热反应,可能是升高温度,或增大压强,故b正确;
c.混合气体总质量不变,容器容积不变,混合气体的密度始终不变,故c错误;
d.t2时平衡正向移动,t4时减小了生成物浓度,平衡正向移动,反应物浓度相应减小,所以容器内NO2的体积分数在t3~t4时最大,故d错误,
故选:ab.
看了氮及其化合物在生活、生产和科技...的网友还看了以下:
砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测.(l)冶炼废水中砷元素主要以亚砷酸( 2020-07-10 …
砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测.(l)冶炼废水中砷元素主要以亚砷酸( 2020-07-14 …
砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测.(l)冶炼废水中砷元素主要以亚砷酸(H 2020-11-01 …
砷(As是)是一种非金属元素,它有+3价和+5价,因此可以形成两种含氧酸--砷酸和亚砷酸.砷酸的化学 2020-11-01 …
(2013•桂平市二模)最近网上盛传黄浦江的死猪与猪饲料的添加剂含有的有机砷有关,认为是有机砷在猪体 2020-11-01 …
补铁补的是几价铁?三价砷有毒,五价砷无毒,那么铁分二价三价? 2020-11-01 …
“信口雌黄”是我们使用频率较高的一个成语,它与元素砷有关.雌黄是一种含三硫化二砷(As2S3)的矿物 2020-11-01 …
吸烟不仅有害自己的健康,而且有害于吸烟场所的那些被动吸烟的公民的健康,所以现在许多公共场所都禁止吸烟 2020-11-01 …
最近网上盛传黄浦江的死猪与猪饲料的添加剂含有的有机砷有关,认为是有机砷在猪体内分解为无机砷(即砒霜) 2020-11-01 …
重庆到宜昌的水路长648km.游轮以每小时36km的速度从重庆开往宜昌.开出t小时后,游轮离开重庆有 2020-11-12 …