早教吧作业答案频道 -->化学-->
(1)砷原子核外电子排布式为.(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为,该化学键能够形成的原因是.(3)H2S和H2O2的主要物理性质比较如表:熔点/K沸点/K标准状况
题目详情
(1)砷原子核外电子排布式为___.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为___,该化学键能够形成的原因是___.
(3)H2S和H2O2的主要物理性质比较如表:
H2S和H2O2的相对分子质量基本相同,造成上述物理性质差异的主要原因___.
(4)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为___.
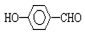 的沸点比
的沸点比 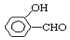 高,原因是:___.
高,原因是:___.
(5)H+可与H2O形成H3O+,H3O+中O原子采用___杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为___.
(6)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaO晶胞体积为___cm3.
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为___,该化学键能够形成的原因是___.
(3)H2S和H2O2的主要物理性质比较如表:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
(4)H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为___.
 的沸点比
的沸点比  高,原因是:___.
高,原因是:___.(5)H+可与H2O形成H3O+,H3O+中O原子采用___杂化.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为___.
(6)CaO与NaCl的晶胞同为面心立方结构,已知CaO晶体密度为ag•cm-3,NA表示阿伏加德罗常数,则CaO晶胞体积为___cm3.
▼优质解答
答案和解析
(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键,
故答案为:配位键;CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道);
(3)O元素非金属性较强,对应的氢化物能形成氢键,且与水分子之间也可以形成氢键,硫元素和水分子间不能形成氢键,所以H2O2的沸点比H2S高,
故答案为:H2O2分子之间会形成氢键,所以熔沸点高,H2O2与水分子之间会形成氢键,所以溶解度大;
(4)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、分子间的范德华力;含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键.
故答案为:O-H键、氢键、范德华力;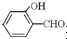 形成分子内氢键,而
形成分子内氢键,而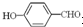 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;
(5)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大,
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小;
(6)1个“CaO”的质量为
=
g,而用均摊法算出一个晶胞含有4个“CaO”,即一个晶胞质量为
g×4=
g,又有ρ=
,则V=
,
V=
g÷ag/cm3=
cm3,则CaO晶胞体积为
cm3,故答案为:
.
故答案为:1s22s22p63s23p63d104s24p3;
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键,
故答案为:配位键;CN-能提供孤对电子,Fe3+能接受孤对电子(或Fe3+有空轨道);
(3)O元素非金属性较强,对应的氢化物能形成氢键,且与水分子之间也可以形成氢键,硫元素和水分子间不能形成氢键,所以H2O2的沸点比H2S高,
故答案为:H2O2分子之间会形成氢键,所以熔沸点高,H2O2与水分子之间会形成氢键,所以溶解度大;
(4)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、分子间的范德华力;含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键.
故答案为:O-H键、氢键、范德华力;
 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;(5)H3O+价层电子对模型为四面体,氧原子采取sp3杂化.
H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大,
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小;
(6)1个“CaO”的质量为
| 56g/mol |
| NA/mol |
| 56 |
| NA |
| 56 |
| NA |
| 224 |
| NA |
| m |
| V |
| m |
| ρ |
V=
| 224 |
| NA |
| 224 |
| aNA |
| 224 |
| aNA |
| 224 |
| aNA |
看了(1)砷原子核外电子排布式为....的网友还看了以下: