早教吧作业答案频道 -->化学-->
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.(1)已知H3AsO3是两性偏酸性的化合物,则H3AsO3中As的化合价为.它与硫酸反应时生成盐
题目详情
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
(1)已知H3AsO3是两性偏酸性的化合物,则H3AsO3中As的化合价为___.它与硫酸反应时生成盐的化学式为___.NaHAsO3溶液呈碱性,原因是___(用离子方程式表示),该溶液中c(H2AsO3-)___C(AsO33-)(填“>”、“<”或“=”).
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在.
①工业上以雄黄为原料制备砷的过程是先在空气中煅烧使其转化为砒霜(As2S3),然后用焦炭还原,写出煅烧时发生反应的化学方程式:___.砒霜有剧毒,卫生防疫分析中鉴定砷的方法是先将试样与锌、硫酸混合在一起反应,将生成的气体(AsH3)导入到热玻璃管中,根据玻璃管产生的现象判断试样中是否含有砷的化合物,写出砒霜转化为AsH3的化学方程式:___.
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为___.
(3)已知砷酸(H3AsO4)是三元酸,有较强的氧化性.
①常温下砷酸的K1=6×10-3、K2=1×10-7,则0.6mol/L的砷酸溶液中c(H+)约为___mol/L.
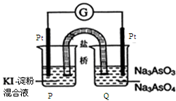
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O═AsO33-+I2+2OH-.当P池中溶液由无色变成蓝色时,正极上的电极反应式为___.当电流计指针归中后向Q池中加入一定量的NaOH,则电子由___(填“P”或“Q”)池中的电流流出.

(1)已知H3AsO3是两性偏酸性的化合物,则H3AsO3中As的化合价为___.它与硫酸反应时生成盐的化学式为___.NaHAsO3溶液呈碱性,原因是___(用离子方程式表示),该溶液中c(H2AsO3-)___C(AsO33-)(填“>”、“<”或“=”).
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在.
①工业上以雄黄为原料制备砷的过程是先在空气中煅烧使其转化为砒霜(As2S3),然后用焦炭还原,写出煅烧时发生反应的化学方程式:___.砒霜有剧毒,卫生防疫分析中鉴定砷的方法是先将试样与锌、硫酸混合在一起反应,将生成的气体(AsH3)导入到热玻璃管中,根据玻璃管产生的现象判断试样中是否含有砷的化合物,写出砒霜转化为AsH3的化学方程式:___.
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为___.
(3)已知砷酸(H3AsO4)是三元酸,有较强的氧化性.
①常温下砷酸的K1=6×10-3、K2=1×10-7,则0.6mol/L的砷酸溶液中c(H+)约为___mol/L.
②某原电池装置如图所示,电池总反应为AsO43-+2I-+H2O═AsO33-+I2+2OH-.当P池中溶液由无色变成蓝色时,正极上的电极反应式为___.当电流计指针归中后向Q池中加入一定量的NaOH,则电子由___(填“P”或“Q”)池中的电流流出.
▼优质解答
答案和解析
(1)H3AsO3中O为-2价,H为+1价,As的化合价为+3价;As的化合价为+3价,硫酸根离子的化合价为-2价,则硫酸盐的化学式As2(SO4)3;NaHAsO3溶液呈碱性是因为HAsO32-在溶液中发生水解,其水解方程式为:;HAsO32-在溶液中电离程度小于水解程度,以水解为主,水解生成H2AsO3-,则该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:+3;As2(SO4)3;HAsO32-+H2O⇌H2AsO3-+OH-;>;
(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫,反应的化学方程式为:As4S4+7O2
2As2O3+4SO2;As2O3与锌、硫酸混合反应生成AsH3和硫酸锌、水,其反应的方程式为:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O;
故答案为:As4S4+7O2
2As2O3+4SO2;As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O;
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,As的化合价从+3价升高到+5价,S的化合价从-2价升高到0价,N的化合价从+5价降低到+4价,则反应中还原剂与氧化剂物质的量之比为1:10;
故答案为:1:10;
(3)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=
,以第一步电离为主,则c(H+)≈
=
=0.06mol/L;
故答案为:0.06;
②P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极,电子应由Q池流出;
故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;Q.
故答案为:+3;As2(SO4)3;HAsO32-+H2O⇌H2AsO3-+OH-;>;
(2)①雄黄As4S4在空气中煅烧与氧气反应转化为砒霜(As2O3)和二氧化硫,反应的化学方程式为:As4S4+7O2
| ||
故答案为:As4S4+7O2
| ||
②As2S3和HNO3的反应为:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,As的化合价从+3价升高到+5价,S的化合价从-2价升高到0价,N的化合价从+5价降低到+4价,则反应中还原剂与氧化剂物质的量之比为1:10;
故答案为:1:10;
(3)①常温下砷酸的K1=6×10-3、K2=1×10-7,K1=
| c(H2AsO4-)c(H+) |
| c(H3ASO4) |
| K1×c(H3ASO4) |
| 6×10-3×0.6 |
故答案为:0.06;
②P池中溶液由无色变成蓝色,说明P池Pt极为负极,则Q池中Pt极为正极.发生的电极反应为AsO43-+H2O+2e-=AsO33-+2OH-,平衡后,加入NaOH溶液,反应逆向进行,此时Q池中Pt极为负极,电子应由Q池流出;
故答案为:AsO43-+H2O+2e-=AsO33-+2OH-;Q.
看了砷(As)是第四周期第VA族元...的网友还看了以下:
关于运动的描述的!运动物体做直线运动,第1S内的平均速度是3m/s,第2秒,第3秒内的平均速度都是6 2020-03-30 …
某物体由静止开始做匀加速直线运动,第1s内通过的位移是3m,则她在最初3s内的位移是 ___m,在 2020-05-16 …
一个物体做匀速直线运动,在第5S时的速度是为1M/S,则在前2S的速度是( ) A,0.5m一个物 2020-05-16 …
汽车在平直公路上行驶,在第1min内的平均速度为5m/s,第2、3min内的平均速度为6m/s,第 2020-05-16 …
一物体做匀变速直线运动,初速度为15m/s,方向向东,第5s末的速度为10m/s,方向向西则第( 2020-05-17 …
如图所示的时间轴,下列关于时刻和时间的说法中正确的是( ) A. t2表示时刻,称为第2 s末或 2020-05-17 …
物体以10m/S的初速度做匀加速运动前4S内的平均速度为18m/S求第四末的速度(2)物体加速度( 2020-06-02 …
留数定理求待定系数X(s)=分子:3s^2+2s+8.分母:s(s+2)(s^2+2s+4).(s 2020-06-04 …
物体做匀加速直线运动,已知第1s末的速度是6m/s,第2s末的速度是8m/s,则下面结论正确的是( 2020-06-06 …
一些关于初中化学的习题1、把4g硫粉放在给定质量的氧气中燃烧,有关实验数据如下表所示,请回答问题: 2020-06-06 …