早教吧作业答案频道 -->化学-->
砷(As)是第四周期第VA族元素,用化学用语回答问题:(1)砷的最高价氧化物对应的水化物化学式是,气态氢化物的稳定性ASH3(填写“大于”或“小于”)NH3.(2)砷在自然界中主
题目详情
砷(As)是第四周期第V A族元素,用化学用语回答问题:
(1)砷的最高价氧化物对应的水化物化学式是___,气态氢化物的稳定性ASH3___(填写“大于”或“小于”)NH3.
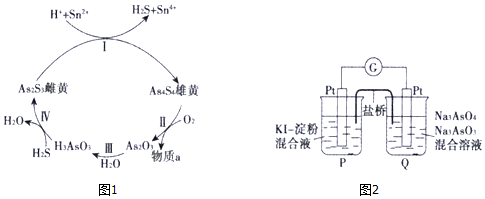
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在.雄黄和雌黄的转换关系如图1所示:
①气体物质a是___(填化学式).
②第I步反应的离子方程式是___.
(3)Na2HAsO3溶液呈碱性,原因是___(用离子方程式表示),该溶液中c(H2AsO3-)___ c(AsO33-)(填“>”、“<”或“=”).
(4)某原电池装置如图2所示,电池总反应为AsO43-++2I-+H2O⇌AsO33-+I2+2OH-.当P池中溶液由无色变蓝色时,正极上的电极反应式为___;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是___.
(1)砷的最高价氧化物对应的水化物化学式是___,气态氢化物的稳定性ASH3___(填写“大于”或“小于”)NH3.
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在.雄黄和雌黄的转换关系如图1所示:
①气体物质a是___(填化学式).
②第I步反应的离子方程式是___.

(3)Na2HAsO3溶液呈碱性,原因是___(用离子方程式表示),该溶液中c(H2AsO3-)___ c(AsO33-)(填“>”、“<”或“=”).
(4)某原电池装置如图2所示,电池总反应为AsO43-++2I-+H2O⇌AsO33-+I2+2OH-.当P池中溶液由无色变蓝色时,正极上的电极反应式为___;当电流计指针归中后向Q中加入一定量的NaOH,电流计指针反向偏转,此时P中的反应式是___.
▼优质解答
答案和解析
(1)As元素的最高正价为+5价,最高价氧化物对应的水化物化学式与磷酸相似,则砷的最高价氧化物对应的水化物化学式是H3AsO4;同主族从上到下,氢化物的稳定性减弱,则气态氢化物的稳定性AsH3小于NH3;
故答案为:H3AsO4;小于;
(2)①雄黄在空气中加热时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为:As4S4+7O2
2As2O3+4SO2,另一种氧化物为二氧化硫;
故答案为:SO2;
②依据转化关系分析可知,雌黄(As2S3)酸性溶液中和Sn2+离子发生氧化还原反应生成As4S4、H2S、Sn4+,结合电荷守恒、原子守恒配平书写离子方程式为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+,
故答案为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+;
(3)Na2HAsO3溶液呈碱性,是因为HAsO32-在溶液中发生水解反应,其水解反应的离子方程式为HAsO32-+H2O⇌H2AsO3-+OH-;Na2HAsO3溶液呈碱性,说HAsO32-的水解程度大于电离程度,所以该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:HAsO32-+H2O⇌H2AsO3-+OH-;>;
(4)电池总反应为AsO43-+2I-+H2O⇌AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池生成I2,发生氧化反应,是负极,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,则正极的电极方程式为AsO43-+2e-+H2O=AsO33-+2OH-;加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,P为正极,P池中I2得电子还原为I-,电极方程式为:I2+2e-=2I-;
故答案为:AsO43-+2e-+H2O=AsO33-+2OH-; I2+2e-=2I-.
故答案为:H3AsO4;小于;
(2)①雄黄在空气中加热时会 两种氧化物,其中的一种氧化物为剧毒的砒霜(As2O3),由原子守恒可知反应为:As4S4+7O2
| ||
故答案为:SO2;
②依据转化关系分析可知,雌黄(As2S3)酸性溶液中和Sn2+离子发生氧化还原反应生成As4S4、H2S、Sn4+,结合电荷守恒、原子守恒配平书写离子方程式为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+,
故答案为:2As2S3+4H++2Sn2+=As4S4+2H2S+2Sn4+;
(3)Na2HAsO3溶液呈碱性,是因为HAsO32-在溶液中发生水解反应,其水解反应的离子方程式为HAsO32-+H2O⇌H2AsO3-+OH-;Na2HAsO3溶液呈碱性,说HAsO32-的水解程度大于电离程度,所以该溶液中c(H2AsO3-)>c(AsO33-);
故答案为:HAsO32-+H2O⇌H2AsO3-+OH-;>;
(4)电池总反应为AsO43-+2I-+H2O⇌AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池生成I2,发生氧化反应,是负极,则Q池中发生正极的还原反应,AsO43-得电子还原为AsO33-,则正极的电极方程式为AsO43-+2e-+H2O=AsO33-+2OH-;加入NaOH溶液,反应逆向进行,此时Q池中发生氧化反应为负极反应,P为正极,P池中I2得电子还原为I-,电极方程式为:I2+2e-=2I-;
故答案为:AsO43-+2e-+H2O=AsO33-+2OH-; I2+2e-=2I-.
看了砷(As)是第四周期第VA族元...的网友还看了以下:
一,多选1.控制细胞膜上通道开闭的因素有()A.渗透压B.pH值C.激素等化学物质D.膜电位E.温 2020-04-26 …
逻辑推理是化学学习中常用的思维方法,下列推理正确的是()A.溶液一定是均一稳定的,但均一稳定的物质 2020-05-13 …
(2013•成都)破坏生态系统稳定性的因素主要有两类:一类是自然因素,如火山、地震等;另一类是因素 2020-05-13 …
破坏生态系统稳定性的因素有两大类:一类是自然因素,另一类是.此外还有引种不合理而带的入侵. 2020-05-13 …
如下是元素周期表的一部分,用元素符号或化学式回答下列问题:(1)在这些元素中是最活泼的金属元素;形 2020-06-09 …
超重元素“稳定岛”的假设预言:自然界中可能存在着原子序数为114号的元素的稳定同位素208X。请根 2020-07-17 …
相对稳定结构是指什么稳定?为什么有些元素本来就是相对稳定结构,而有些元素需要在化学反应后得到或失去 2020-07-20 …
β-胡萝卜素(化学式:C40H56)是类胡萝卜素之一,是一种橘黄色脂溶性的化合物,它是自然界中最普遍 2020-10-29 …
超重元素“稳定岛”的假设预言:自然界中可能存在着原子序数为114的元素的稳定同位素208X.1999 2020-11-23 …
近来有人提出存在着超重元素稳定岛的假说,认为在质子数114、中子数184处,有一个稳定岛.这一假说有 2020-12-14 …