早教吧作业答案频道 -->化学-->
钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途.从某含钴工业废料中回收钴的工艺流程如图:已知:含钴废料的成分成分AlLiCo2O3Fe2O3其他不溶于强酸的
题目详情
钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途.从某含钴工业废料中回收钴的工艺流程如图:
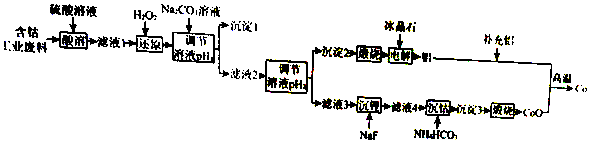
已知:
Ⅲ.离子浓度小于等于1.0×10-5mol•L-1时,认为该离子沉淀完全.
请回答下列问题:
(1)NaF的电子式为___.
(2)“沉淀1”的化学式为___.“调节溶液pH2”的范围为___.
(3)“还原”时发生反应的离子方程式为___.“沉钴”时发生反应的离子方程式为___.
(4)制备Co时,“补充铝”的原因为___.
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=___.
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,其正极反应式为___.

已知:
| 含钴废料的成分 | |||||
| 成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
| 质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
| Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
| 金属离子 | Fe3+ | Co2+ | Al3+ |
| 开始沉淀的pH | 1.9 | 7.15 | 3.4 |
| 沉淀完全的pH | 3.2 | 9.15 | 4.7 |
请回答下列问题:
(1)NaF的电子式为___.
(2)“沉淀1”的化学式为___.“调节溶液pH2”的范围为___.
(3)“还原”时发生反应的离子方程式为___.“沉钴”时发生反应的离子方程式为___.
(4)制备Co时,“补充铝”的原因为___.
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=___.
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,其正极反应式为___.
▼优质解答
答案和解析
(1)NaF为离子化合物,电子式为:Na+[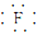 ]-;
]-;
故答案为:Na+[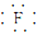 ]-;
]-;
(2)根据分析沉淀1为Fe(OH)3;调节pH2最终沉淀了铝离子,根据表中数据,pH为4.7≤pH2<7.15;
故答案为:Fe(OH)3;4.7≤pH2<7.15;
(3)还原时的反应为过氧化氢还原Co3+,离子反应为:2Co3++H2O2=2Co2++O2↑2H+;碳酸氢铵沉钴反应为:Co2++2HCO3-=CoCO3↓+CO2↑+H2O;
故答案为:2Co3++H2O2=2Co2++O2↑2H+;Co2-+2HCO3-=CoCO3↓+CO2↑+H2O;
(4)制备Co时,反应为:3CoO+2Al
Al2O3+3Co,原混合物中Al和Co的物质的量之比小于2:3,需要补充铝;
故答案为:原混合物中Al和Co的物质的量之比小于2:3;
(5)A1(OH)3 的溶度积常数 Ksp=c(Al3+)•c3(OH-)=1.0×10-5•(10-9.3)3=1.3×10-33;
故答案为:1.3×10-33;
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,正极发生还原反应,反应式为:2SOCl2+4e-=S+SO2+4Cl-;
故答案为:2SOCl2+4e-=S+SO2+4Cl-.
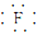 ]-;
]-;故答案为:Na+[
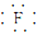 ]-;
]-;(2)根据分析沉淀1为Fe(OH)3;调节pH2最终沉淀了铝离子,根据表中数据,pH为4.7≤pH2<7.15;
故答案为:Fe(OH)3;4.7≤pH2<7.15;
(3)还原时的反应为过氧化氢还原Co3+,离子反应为:2Co3++H2O2=2Co2++O2↑2H+;碳酸氢铵沉钴反应为:Co2++2HCO3-=CoCO3↓+CO2↑+H2O;
故答案为:2Co3++H2O2=2Co2++O2↑2H+;Co2-+2HCO3-=CoCO3↓+CO2↑+H2O;
(4)制备Co时,反应为:3CoO+2Al
| ||
故答案为:原混合物中Al和Co的物质的量之比小于2:3;
(5)A1(OH)3 的溶度积常数 Ksp=c(Al3+)•c3(OH-)=1.0×10-5•(10-9.3)3=1.3×10-33;
故答案为:1.3×10-33;
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2═4LiCl+S+SO2,正极发生还原反应,反应式为:2SOCl2+4e-=S+SO2+4Cl-;
故答案为:2SOCl2+4e-=S+SO2+4Cl-.
看了钴(Co)是重要的稀有金属,在...的网友还看了以下:
木块下面悬挂一块金属块,木块仍浮在水面,下面哪种说法正确()A.木块的重力等于木块的浮力B.金属块的 2020-03-31 …
木块下面悬挂一块金属块,木块仍浮在水面,下面哪种说法正确()A.木块的重力等于木块的浮力B.金属块的 2020-03-31 …
一个整式与多项式x的平方减y的平方的差为x的平方加y的平方,则这个整式为()一个整式与多项式x的平 2020-04-22 …
A市在B市的12km的位置,给B市发货的车以40km/时送货,以60km/时返回A市,往返1时10 2020-04-27 …
用三连格(横的或竖的)去框右面表格中的数,每次框三个数.是11~70之间.(1)框出的三个数的和最 2020-05-13 …
如果压缩若干金属分子,金属的体积可以无限缩小,到一定程度的时候停止施力,会发生什么?如果现有无限的 2020-05-13 …
用不同频率的光照射某金属产生光电效应,测量金属的遏止电压Uc与入射光频率ν,得到Uc-ν图象如图所 2020-05-13 …
某工厂的废金属屑中主要成分为Cu、Fe和Al,此外还含有少量Al2O3和Fe2O3,该厂用上述废金 2020-05-13 …
在长为884米的金属管的一端敲击一下,在另一端先后到两个声音,两声相隔2.43秒,声音在金属管中的 2020-05-13 …
镁有“国防金属”的美誉.在元素周期表中,镁元素的信息如图所示,对图中信息解释不正确的是()A.属于 2020-05-13 …