早教吧作业答案频道 -->化学-->
钴(Co)是人体必需的微量元素.含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用.请回答下列问题:(1)Co基态原子的外围电子排布式为;(2)
题目详情
钴(Co)是人体必需的微量元素.含钴化合物作为颜料,具有悠久的历史,在机械制造、磁性材料等领域也具有广泛的应用.请回答下列问题:
(1)Co基态原子的外围电子排布式为___;
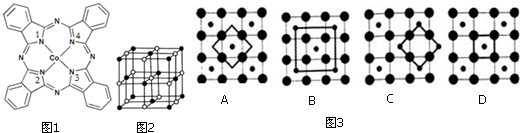
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用.其结构如图1所示,中心离子为钴离子.
①酞菁钴中三种非金属原子的电负性由大到小的顺序为___;
(用相应的元素符号作答);碳原子的杂化轨道类型为___;
②与钴离子通过配位键结合的氮原子的编号是___;
(3)Co的一种氧化物的晶胞如2图所示,在该晶体中与一个钴原子等距离且最近的钴原子有___个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如图所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图3不能描述CoO2的化学组成的是___.
(1)Co基态原子的外围电子排布式为___;
(2)酞菁钴近年来在光电材料、非线性光学材料、光动力学疗法中的光敏剂、催化剂等方面得到了广泛的应用.其结构如图1所示,中心离子为钴离子.
①酞菁钴中三种非金属原子的电负性由大到小的顺序为___;
(用相应的元素符号作答);碳原子的杂化轨道类型为___;
②与钴离子通过配位键结合的氮原子的编号是___;
(3)Co的一种氧化物的晶胞如2图所示,在该晶体中与一个钴原子等距离且最近的钴原子有___个;筑波材料科学国家实验室一个科研小组发现了在 5K 下呈现超导性的晶体,该晶体具有CoO2的层状结构(如图所示,小球表示Co原子,大球表示O原子).下列用粗线画出的重复结构单元示意图3不能描述CoO2的化学组成的是___.

▼优质解答
答案和解析
(1)Co为27号元素,原子核外电子数为27,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d74s2或[Ar]3d74s2,
故答案为:1s22s22p63s23p63d74s2或[Ar]3d74s2;
(2)①酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性N>C>H;分子中C原子均形成3个σ键,没有孤对电子,杂化轨道数目为3,碳原子的杂化轨道类型为 sp2,
故答案为:N>C>H;sp2;
②含有孤对电子的N原子与Co通过配位键结合,形成配位键后形成4对共用电子对,形成3对共用电子对的N原子形成普通的共价键,1号、3号N原子形成3对共用电子对为普通共价键,2号、4号N原子形成4对共用电子对,与Co通过配位键结合,
故答案为:2、4;
(3)由氧化物晶胞结构可知晶胞中Co、O原子数目之比为1:1,假设黑色球为Co原子,以顶点Co原子为研究对象,与之等距离且最近的钴原子位于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,在该晶体中与一个钴原子等距离且最近的钴原子数目为
=12;
CoO2的重复结构单元示意图中Co、O原子数目之比应为1:2,由图象可知:
A中Co、O原子数目之比为1:4×
=1:2,符合,
B中Co、O原子数目之比为(1+4×
):4=1:2,符合,
C中Co、O原子数目之比为4×
:4×
=1:2,符合,
D中Co、O原子数目之比为1:4×
=1:1,不符合,
故答案为:12;D.
故答案为:1s22s22p63s23p63d74s2或[Ar]3d74s2;
(2)①酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性N>C>H;分子中C原子均形成3个σ键,没有孤对电子,杂化轨道数目为3,碳原子的杂化轨道类型为 sp2,
故答案为:N>C>H;sp2;
②含有孤对电子的N原子与Co通过配位键结合,形成配位键后形成4对共用电子对,形成3对共用电子对的N原子形成普通的共价键,1号、3号N原子形成3对共用电子对为普通共价键,2号、4号N原子形成4对共用电子对,与Co通过配位键结合,
故答案为:2、4;
(3)由氧化物晶胞结构可知晶胞中Co、O原子数目之比为1:1,假设黑色球为Co原子,以顶点Co原子为研究对象,与之等距离且最近的钴原子位于面心,每个顶点为8个晶胞共用,每个面心为2个晶胞共用,在该晶体中与一个钴原子等距离且最近的钴原子数目为
| 3×8 |
| 2 |
CoO2的重复结构单元示意图中Co、O原子数目之比应为1:2,由图象可知:
A中Co、O原子数目之比为1:4×
| 1 |
| 2 |
B中Co、O原子数目之比为(1+4×
| 1 |
| 4 |
C中Co、O原子数目之比为4×
| 1 |
| 4 |
| 1 |
| 2 |
D中Co、O原子数目之比为1:4×
| 1 |
| 4 |
故答案为:12;D.
看了钴(Co)是人体必需的微量元素...的网友还看了以下:
经济危机下的新加坡劳务 需要月薪多少能生活?有没有供吃和住的地方?一个月能剩4000-5000就可 2020-05-16 …
下列属于劳动教养管理所的内部机关科室的必设机构的是( )。 A.行政办事机构 B.具体组织劳动教养 2020-05-18 …
关于党对公安机关的领导,下列说法正确的是( )A.公安工作必须置于党的间接领导之下B.公安机关必须 2020-05-19 …
下列有关国务院行政机构设立、撤销或者合并的说法,错误的是哪些选项?A.所有国务院行政机构的设立、撤 2020-05-20 …
● 以下对机房环境的描述中,错误的是(46) 。 (46)A.机房可以使用防静电地板 B.机房的装修 2020-05-25 …
● 在以下机房环境的描述中,错误的是(67) 。 (67)A.机房必须使用防静电地板 B.机房的装修 2020-05-26 …
在以下机房环境的描述中,错误的是(67)。A.机房必须使用防静电地板B.机房的装修必须采用防火材料C 2020-05-26 …
以下对机房环境的描述中,错误的是(46)。A.机房可以使用防静电地板B.机房的装修必须采用防火材料C 2020-05-26 …
机群属于MPP架构。机群欲实现高性能计算,必须实现单一系统映像意义下的系统共享。实现机群架构下的系统 2020-05-31 …
接在汇聚层交换机下的物理子网之间的通信经常不规则地无故断路,建议采用()分析和解决问题。 2020-05-31 …