早教吧作业答案频道 -->化学-->
某化工厂利用氧化钴矿石制取CoC2O4(草酸钴)的工艺流程如下:(已知:黄钠铁矾不溶于水,可溶于酸)(1)步骤①中研究矿石粒度对钴浸出率的影响如表.从表中分析选择矿石粒度为目
题目详情
某化工厂利用氧化钴矿石制取CoC2O4(草酸钴)的工艺流程如下:(已知:黄钠铁矾不溶于水,可溶于酸)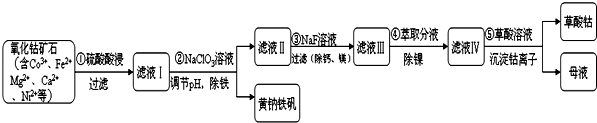
(1)步骤①中研究矿石粒度对钴浸出率的影响如表.从表中分析选择矿石粒度为___目.
(2)步骤①需要用到的玻璃仪器,除烧杯外还有___.
(3)Ⅰ.步骤②中NaClO3将Fe2+氧化成Fe3+的离子方程式并标出电子转移方向和数目___.
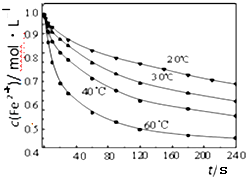
Ⅱ.探究温度对步骤②中NaClO3将Fe2+氧化成Fe3+的影响,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(Fe2+)的变化,结果如图,请从图中分析最合适的温度下,在0s 至120s内的平均反应速率v(Fe2+)=___ mol•L-1•min-1.
(4)请写出步骤 ③中除去镁离子的离子反应方程式___.
(5)若要检验黄钠铁矾[Na2 Fe6(SO4)4(OH)12]中含有的金属元素,请简述实验方案:___.
(6)从绿色化学角度分析,母液中可循环利用的物质为___(填写名称).

(1)步骤①中研究矿石粒度对钴浸出率的影响如表.从表中分析选择矿石粒度为___目.
| 序号 | 矿石粒度/目 | 钴浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
(3)Ⅰ.步骤②中NaClO3将Fe2+氧化成Fe3+的离子方程式并标出电子转移方向和数目___.
Ⅱ.探究温度对步骤②中NaClO3将Fe2+氧化成Fe3+的影响,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(Fe2+)的变化,结果如图,请从图中分析最合适的温度下,在0s 至120s内的平均反应速率v(Fe2+)=___ mol•L-1•min-1.

(4)请写出步骤 ③中除去镁离子的离子反应方程式___.
(5)若要检验黄钠铁矾[Na2 Fe6(SO4)4(OH)12]中含有的金属元素,请简述实验方案:___.
(6)从绿色化学角度分析,母液中可循环利用的物质为___(填写名称).
▼优质解答
答案和解析
氧化钴矿石制取CoC2O4(草酸钴),含有Co3+、Fe2+、Mg2+、Ca2+、Ni2+,黄钠铁矾不溶于水,可溶于酸,加入硫酸酸浸过滤得到滤液Ⅰ加入NaClO3溶液调节溶液PH除去Fe3+生成氢氧化铁沉淀除去,过滤得到滤液Ⅱ,加入NaF除去Mg2+、Ca2+离子,过滤得到滤液Ⅲ,加入萃取剂除去Ni2+,得到滤液Ⅳ中加入草酸溶液沉淀钴离子过滤得到草酸钴,
(1)矿石粒度对钴浸出率的影响可知,选择矿石粒度应使浸出率最高,矿石粒度为-200目,钴浸出率41.18%,浸出率最高,
故答案为:-200;
(2)步骤①是过滤装置,据此分析需要用到的玻璃仪器,用到的玻璃仪器,除烧杯外还有漏斗、玻璃棒,
故答案为:漏斗、玻璃棒;
(3)NaClO3将Fe2+氧化成Fe3+,酸溶液中氯酸根离子被还原为氯离子,结合离子电荷守恒,原子守恒、电子守恒配平书写化学方程式,标注电子转移,得到的离子方程式为: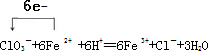 ,
,
故答案为: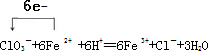 ;
;
(4)步骤 ③中除去镁离子的反应是氟离子和镁离子结合生成氟化镁沉淀,反应的离子方程式为:Mg2++2F-=MgF2↓,
故答案为:Mg2++2F-=MgF2↓;
(5)取黄钠铁矾用盐酸溶液溶解,分成两份,一份用焰色反应检 验钠元素的存在,另一份检验铁离子的存在,实验设计为:取黄钠铁矾用盐酸溶液溶解,分成两份,一份做火焰色反应,火焰为黄色证明有Na+存在;另一份向其中滴加KSCN溶液,溶液变成血红色,证明有Fe3+存在,
故答案为:取黄钠铁矾用盐酸溶液溶解,分成两份,一份做火焰色反应,火焰为黄色证明有Na+存在;另一份向其中滴加KSCN溶液,溶液变成血红色,证明有Fe3+存在;
(6)母液中硫酸钴和草酸反应生成草酸钴沉淀和硫酸,参与反应最后又生成的物质可以循环使用,硫酸可以循环使用,
故答案为:硫酸.
(1)矿石粒度对钴浸出率的影响可知,选择矿石粒度应使浸出率最高,矿石粒度为-200目,钴浸出率41.18%,浸出率最高,
故答案为:-200;
(2)步骤①是过滤装置,据此分析需要用到的玻璃仪器,用到的玻璃仪器,除烧杯外还有漏斗、玻璃棒,
故答案为:漏斗、玻璃棒;
(3)NaClO3将Fe2+氧化成Fe3+,酸溶液中氯酸根离子被还原为氯离子,结合离子电荷守恒,原子守恒、电子守恒配平书写化学方程式,标注电子转移,得到的离子方程式为:
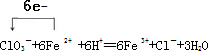 ,
,故答案为:
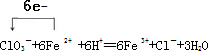 ;
;(4)步骤 ③中除去镁离子的反应是氟离子和镁离子结合生成氟化镁沉淀,反应的离子方程式为:Mg2++2F-=MgF2↓,
故答案为:Mg2++2F-=MgF2↓;
(5)取黄钠铁矾用盐酸溶液溶解,分成两份,一份用焰色反应检 验钠元素的存在,另一份检验铁离子的存在,实验设计为:取黄钠铁矾用盐酸溶液溶解,分成两份,一份做火焰色反应,火焰为黄色证明有Na+存在;另一份向其中滴加KSCN溶液,溶液变成血红色,证明有Fe3+存在,
故答案为:取黄钠铁矾用盐酸溶液溶解,分成两份,一份做火焰色反应,火焰为黄色证明有Na+存在;另一份向其中滴加KSCN溶液,溶液变成血红色,证明有Fe3+存在;
(6)母液中硫酸钴和草酸反应生成草酸钴沉淀和硫酸,参与反应最后又生成的物质可以循环使用,硫酸可以循环使用,
故答案为:硫酸.
看了某化工厂利用氧化钴矿石制取Co...的网友还看了以下:
铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO.工业上从铝土矿中提取Al可采用 2020-04-06 …
2013年3月17日,第28届昆明市青少年科技创新大赛圆满落幕,从近万项参赛作品中初选出的524项 2020-04-07 …
铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO.工业上从铝土矿中提取铝可采用如 2020-05-13 …
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制备铝的工艺流程:已知:铝土 2020-05-13 …
金属铝质轻且有良好的防腐蚀性,在国防工业、生产、生活中具有非常重要的作用.图是从铝土矿中制备铝的工 2020-05-13 …
某化工厂尝试用软锰矿、闪锌矿(含有Fe、Cu、Al等元素杂质)联合制备工业产品MnO2和Zn.(已 2020-07-21 …
工作面绝对瓦斯涌出量与通风负压的关系我矿为突出矿井,抽出式通风,走向长臂采煤法,工作面采用U型通风方 2020-12-05 …
以下为1893-1930年出口原料按经济类别分类比重(百分比),从表中可以看出()年份原料农产品矿产 2020-12-16 …
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得.铝土矿的主要成 2021-02-09 …
(2014•普兰店市模拟)钢铁在各个领域中发挥着重要的作用.(1)工业上可用焦炭、石灰石、铁矿石为原 2021-02-19 …