早教吧作业答案频道 -->化学-->
三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备三氯化六氨合钴(Ⅲ)的化学方程式为:2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O实验流程如图1:已知:[Co(NH3)6]Cl3在水
题目详情
三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备三氯化六氨合钴(Ⅲ)的化学方程式为:
2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O
实验流程如图1:
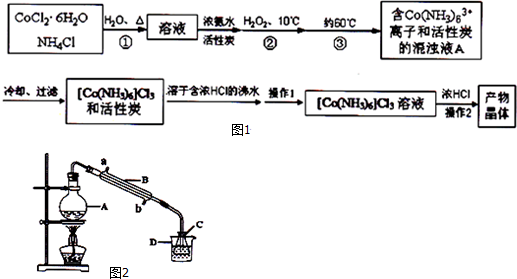
已知:[Co(NH3)6]Cl3 在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
请回答下列问题:
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是___.
(2)H2O2的作用是___,第③步中保持60℃的加热方法是___.
(3)过滤是滤纸先用蒸馏水湿润,然后用___压实滤纸,排出滤纸与漏斗之间的气泡.
(4)实验操作1为___,[Co(NH3)6]Cl3 溶液中加入浓HCl的目的是___.
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl(装置见图2),
C中装0.5000mol/L的盐酸25.00mL,D中装有冰水.加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2~3滴甲基红指示剂,用0.5000mol/L的NaOH滴定.已知:
①仪器A的名称是___.
②当滴定到终点时,共需消耗NaOH溶液___mL(精确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将___(填“偏大”、“偏小”或“不变”).
2CoCl2•6H2O+10NH3+2NH4Cl+H2O2═2[Co(NH3)6]Cl3+14H2O
实验流程如图1:

已知:[Co(NH3)6]Cl3 在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
| 温度(℃) | 0 | 20 | 47 |
| 溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是___.
(2)H2O2的作用是___,第③步中保持60℃的加热方法是___.
(3)过滤是滤纸先用蒸馏水湿润,然后用___压实滤纸,排出滤纸与漏斗之间的气泡.
(4)实验操作1为___,[Co(NH3)6]Cl3 溶液中加入浓HCl的目的是___.
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl(装置见图2),
C中装0.5000mol/L的盐酸25.00mL,D中装有冰水.加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2~3滴甲基红指示剂,用0.5000mol/L的NaOH滴定.已知:
| 指示剂 | 颜色 | 变色的pH范围 | ||
| 甲基红 | 红 | 橙 | 黄 | 4.4~6.2 |
②当滴定到终点时,共需消耗NaOH溶液___mL(精确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将___(填“偏大”、“偏小”或“不变”).
▼优质解答
答案和解析
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2•6H2O晶体,加热煮沸和研细的目的是加速固体的溶解,故答案为:加速固体溶解;
(2)依据流程可知向CoCl2•6H2O加入过氧化氢后得到Co(NH3)63+,加入过氧化氢是氧化剂能把+2价钴离子为+3价,第③步中保持60℃的加热方法是水浴加热,
故答案为:做氧化剂;水浴加热;
(3)结合过滤的基本操作,过滤时滤纸先用蒸馏水润湿,然后用玻璃棒压实滤纸,排出滤纸和漏斗之间的气泡,
故答案为:玻璃棒;
(4)流程图提供的信息可知,实验操作Ⅰ为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl增大氯离子浓度,依据沉淀溶解平衡理论,平衡想析出晶体的方向移动,所以加入浓盐酸的目的是有利于[Co(NH3)6]Cl3析出,提高产率,
故答案为:有利于[Co(NH3)6]Cl3析出,提高产率;
(5)①仪器特征和图形可知仪器A名称为圆底烧瓶,故答案为:圆底烧瓶;
②0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),物质的量=
=0.001mol,滴定过程分析可知发生的反应依次为[Co(NH3)6]Cl3+3NaOH═Co(OH)3↓+6NH3↑+3NaCl,NH3+HCl=NH4Cl,HCl+NaOH=NaCl+H2O,放出氨气物质的量总计为0.006mol,消耗HCl物质的量0.006mol,HCl总物质的量=0.0250L×0.5mol/L=0.0125mol,所以消耗剩余HCl需要氢氧化钠物质的量=0.0125mol-0.006mol=0.0065mol,当滴定到终点时,共消耗NaOH溶液的体积=
=0.0013L=13.00ml,
故答案为:13.00;
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,导致酸液减少,消耗氢氧化钠的量减少,测定氨气量增多,x值将偏大,故答案为:偏大.
(2)依据流程可知向CoCl2•6H2O加入过氧化氢后得到Co(NH3)63+,加入过氧化氢是氧化剂能把+2价钴离子为+3价,第③步中保持60℃的加热方法是水浴加热,
故答案为:做氧化剂;水浴加热;
(3)结合过滤的基本操作,过滤时滤纸先用蒸馏水润湿,然后用玻璃棒压实滤纸,排出滤纸和漏斗之间的气泡,
故答案为:玻璃棒;
(4)流程图提供的信息可知,实验操作Ⅰ为趁热过滤,[Co(NH3)6]Cl3 溶液中加入浓HCl增大氯离子浓度,依据沉淀溶解平衡理论,平衡想析出晶体的方向移动,所以加入浓盐酸的目的是有利于[Co(NH3)6]Cl3析出,提高产率,
故答案为:有利于[Co(NH3)6]Cl3析出,提高产率;
(5)①仪器特征和图形可知仪器A名称为圆底烧瓶,故答案为:圆底烧瓶;
②0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),物质的量=
| 0.2675g |
| 267.5g/mol |
| 0.0065mol |
| 0.5mol/L |
故答案为:13.00;
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,导致酸液减少,消耗氢氧化钠的量减少,测定氨气量增多,x值将偏大,故答案为:偏大.
看了三氯化六氨合钴(Ⅲ)是一种重要...的网友还看了以下:
一个等腰三角形的地窖和定焦度数之比是2:1,顶角是多少度?一种消毒液,说明书如下1.瓜果,厨具1: 2020-05-13 …
17个科学家,6人一组,7个生物学的,4个物理学,6个化学的,求有多少种组合?2.求2个物理,2个 2020-05-14 …
有ABC三种货物,甲购A物3件,B物5件,C物1件付款20元,乙购A物4件,B物7件,C物1件付款 2020-06-18 …
下列说法不正确的是()A.利用氯化钴等物质,在含有不同数目的结晶水分子时呈现不同的颜色这个性质加入 2020-06-29 …
实验化学——四氯合钴(Ⅱ)离子与二氯化钴的区别那个,新课标里没怎么提过络合物,1.〔CoCl4〕2ˉ 2020-11-01 …
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用. 2020-11-01 …
镍含量85.28铬含量9.66铜含量2.23钴含量1.25铁1.65,是什么钢材 2020-11-01 …
某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用. 2020-11-01 …
淮安作为最为著名1苏北名城,自古以来就有着良好1环境.这里生长着多种植物.植物1根既能吸收土壤大1营 2020-11-12 …
有甲、乙、丙三种货物,若购买甲种货物2件,乙种货物1件,丙种货物1件,则要花5元:若购买甲种货物1件 2020-11-19 …