早教吧作业答案频道 -->化学-->
锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:已知25℃,部分物质的溶度积常数如表:物质Mn(OH)2Co(OH
题目详情
锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
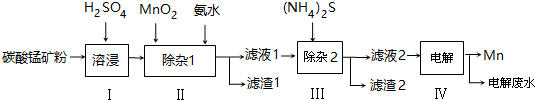
已知25℃,部分物质的溶度积常数如表:
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是:___.(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为___(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为___.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是___.
(4)滤液2中,c(Co2+):c(Ni2+)=___.
(5)将质量为a kg的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为___.(用含a、b、c的式子表达,无需化简)

已知25℃,部分物质的溶度积常数如表:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为___(填化学式).已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为___.
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是___.
(4)滤液2中,c(Co2+):c(Ni2+)=___.
(5)将质量为a kg的碳酸锰矿经上述流程处理后得到单质Mn b kg.若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为___.(用含a、b、c的式子表达,无需化简)
▼优质解答
答案和解析
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率,所以为了提高浸取率可采取的措施有加热或搅拌或增大硫酸浓度等,
故答案为:升高温度、适当增大硫酸浓度、减小矿粉颗粒直径;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加入氨水调节pH为5.0~6.0,发生Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+,可得到沉淀Fe(OH)3,
故答案为:Fe(OH)3;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+;
(3)向滤液中滴入适量的(NH4)2S溶液,目的是除去Cu2+、Zn2+,若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失,
故答案为:若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失;
(4)CoS、NiS的Ksp分别为5.0×10-22、1.0×10-22,加入足量(NH4)2S溶液后,生成CoS、NiS沉淀,溶液中c(Co2+):c(Ni2+)=5.0×10-22:1.0×10-22=5:1,
故答案为:5:1;
(5)滤渣1为为Fe(OH)3,质量为c kg,则n(Fe3+)=n(Fe(OH)3)=
mol,由2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O可知n(MnO2)=
×
mol,
将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg,n(Mn)=
mol,
可知n(MnCO3)=
mol-
×
mol,
m(MnCO3)=(
mol-
×
mol)×115g/mol,
则原碳酸锰矿中MnCO3的质量分数为
×100%,
故答案为:
×100%.
故答案为:升高温度、适当增大硫酸浓度、减小矿粉颗粒直径;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加入氨水调节pH为5.0~6.0,发生Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+,可得到沉淀Fe(OH)3,
故答案为:Fe(OH)3;2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+;
(3)向滤液中滴入适量的(NH4)2S溶液,目的是除去Cu2+、Zn2+,若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失,
故答案为:若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失;
(4)CoS、NiS的Ksp分别为5.0×10-22、1.0×10-22,加入足量(NH4)2S溶液后,生成CoS、NiS沉淀,溶液中c(Co2+):c(Ni2+)=5.0×10-22:1.0×10-22=5:1,
故答案为:5:1;
(5)滤渣1为为Fe(OH)3,质量为c kg,则n(Fe3+)=n(Fe(OH)3)=
| 1000c |
| 107 |
| 1 |
| 2 |
| 1000c |
| 107 |
将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg,n(Mn)=
| 1000b |
| 55 |
可知n(MnCO3)=
| 1000b |
| 55 |
| 1 |
| 2 |
| 1000c |
| 107 |
m(MnCO3)=(
| 1000b |
| 55 |
| 1 |
| 2 |
| 1000c |
| 107 |
则原碳酸锰矿中MnCO3的质量分数为
(b-
| ||||||
| a |
故答案为:
(b-
| ||||||
| a |
看了锰的用途非常广泛,以碳酸锰矿(...的网友还看了以下:
下列物质中不属于混合物的是()A.蔗糖完全水解的产物B.蛋白质完全水解的产物C.油脂皂化反应后的产 2020-05-13 …
下列能说明技术是推动社会发展和文明进步的主要动力之一的是()A.煤油灯的产生B.金属卤化物灯的产生 2020-05-15 …
通常用于衡量一个国家石油化工发展水平标志的是?A.石油的产量B.乙烯的产量C.天然气的产量.D.硫 2020-05-16 …
能源生产企业产成品库存主要包括( )。A.盘点中的账外产品 B.未验收入库的产品C.盘亏的产品 D. 2020-05-21 …
工业销售产值的计算范围不包括( )。A.非本期生产并销售的产品B.本期生产并销售的产品C.半成品、在 2020-05-30 …
残积层是()A.淋滤作用的产物B.洗刷作用的产物C.冲刷作用的产物D.河流地质作用的产物 2020-06-05 …
从起源上说,意识是( )A.感性认识的产物B.理性认识的产物C.社会性劳动的产物D.从劳动中产生的 2020-06-05 …
下列各项中,属于能源生产企业产成品库存的是()。A.未验收入库的产品B.盘亏的产品C.代外单位保管的 2020-06-07 …
能源生产企业的产品库存包括()A.尚未验收入库的产品B.未办理退库手续的有质量问题的产品C.代外单 2020-06-07 …
能源生产企业的产成品库存包括()。A.尚未验收入库的产品B.未办理退库手续的有质量问题的产品C.代 2020-06-07 …