早教吧作业答案频道 -->化学-->
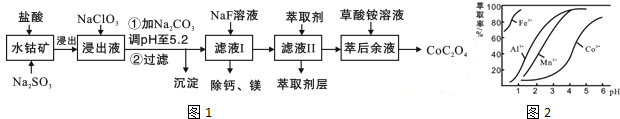
一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图1已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;②部分阳离子以
题目详情
一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取草酸钴的工艺流程如图1
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是___.
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为___;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为___(标准状况).
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是___;使用萃取剂适宜的pH是___(填选项序号).
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=___.
(5)工业上用氨水吸收废气中的SO2.已知NH3•H2O的电离平衡常数K=1.8×10-5mol•L,H2SO3的电离平衡常数K1=1.2×10-2mol•L-4,K2=1.3×10-8mol•L-1.在通入废气的过程中:
①当恰好形成正盐时,溶液中离子浓度的大小关系为___.
②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为___.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)制取NaClO3可以将氯气通入到热的浓氢氧化钠溶液,该反应的离子方程式为___;实验需要制取10.65克NaClO3,需要的氯气由电解食盐水生成,若不考虑反应过程中的损失,则同时生成的氢气的体积为___(标准状况).
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示.滤液Ⅱ中加入萃取剂的作用是___;使用萃取剂适宜的pH是___(填选项序号).
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10.当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=___.
(5)工业上用氨水吸收废气中的SO2.已知NH3•H2O的电离平衡常数K=1.8×10-5mol•L,H2SO3的电离平衡常数K1=1.2×10-2mol•L-4,K2=1.3×10-8mol•L-1.在通入废气的过程中:
①当恰好形成正盐时,溶液中离子浓度的大小关系为___.
②当恰好形成酸式盐时,加入少量NaOH溶液,反应的离子方程式为___.
▼优质解答
答案和解析
含钴废料中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则进入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+.工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴.
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,
故答案为:将Co3+、Fe3+还原;
(2)氯气通入到热的浓氢氧化钠溶液得到NaClO3,还生成氯化钠与水,反应离子方程式为:3Cl2+6OH-
ClO3-+5Cl-+3H2O,10.65克NaClO3的物质的量为
=0.1mol,由方程式可知需要氯气物质的量为0.1mol×3=0.3mol,根据电子转移守恒可知,电解生成氢气与氯气的物质的量相等,故氢气体积为0.3mol×22.4L/mol=6.72L,
故答案为:3Cl2+6OH-
ClO3-+5Cl-+3H2O;6.72;
(3)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3时最佳,
故答案为:除去Mn2+;B;
(4)根据溶度积可知c(Mg2+):c(Ca2+)=
=
=0.7
故答案为:0.7;
(5)①NH3•H2O的电离平衡常数K=1.8×10-5mol•L,H2SO3的电离平衡常数K2=1.3×10-8mol•L-1,则SO32-的水解程度大于NH4+的水解程度,溶液呈碱性,溶液中氢氧根离子源于水的电离、SO32-的水解,溶液中c(OH-)>c(HSO3-),故溶液中离子浓度大小为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
②由电离平衡常数,可知NH4++OH-⇌NH3.H2O的平衡常数小于HSO3-+OH-⇌SO32-+H2O平衡常数,故加入少量NaOH溶液先与HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O,
故答案为:HSO3-+OH-=SO32-+H2O.
(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,
故答案为:将Co3+、Fe3+还原;
(2)氯气通入到热的浓氢氧化钠溶液得到NaClO3,还生成氯化钠与水,反应离子方程式为:3Cl2+6OH-
| ||
| 10.65g |
| 106.5g/mol |
故答案为:3Cl2+6OH-
| ||
(3)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn的萃取率增大很多,而pH=5时,Co2+的萃取率比较大,损失严重,故pH=3时最佳,
故答案为:除去Mn2+;B;
(4)根据溶度积可知c(Mg2+):c(Ca2+)=
| Ksp(MgF2) |
| Ksp(CaF2) |
| 7.35×10-11 |
| 1.05×10-10 |
故答案为:0.7;
(5)①NH3•H2O的电离平衡常数K=1.8×10-5mol•L,H2SO3的电离平衡常数K2=1.3×10-8mol•L-1,则SO32-的水解程度大于NH4+的水解程度,溶液呈碱性,溶液中氢氧根离子源于水的电离、SO32-的水解,溶液中c(OH-)>c(HSO3-),故溶液中离子浓度大小为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:c(NH4+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
②由电离平衡常数,可知NH4++OH-⇌NH3.H2O的平衡常数小于HSO3-+OH-⇌SO32-+H2O平衡常数,故加入少量NaOH溶液先与HSO3-反应,反应的离子方程式为:HSO3-+OH-=SO32-+H2O,
故答案为:HSO3-+OH-=SO32-+H2O.
看了一种利用水钴矿(主要成分为Co...的网友还看了以下:
从H、O、C、N、Cl、Ca、Na、Ba、S、Fe十种元素中选适当的元素,用元素符号、离子符号、化 2020-05-02 …
从H、O、C、N、Cl、Ca、Na、Ba、S、Fe十种元素中选适当的元素,用元素符号、离子符号、化 2020-05-02 …
下列说法中,不正确的是()A.离子晶体中不一定含有金属离子B.在含有阳离子的化合物的晶体中,一定含 2020-05-13 …
下列说法中,不正确的是()A.离子晶体中不一定含有金属离子B.在含有阳离子的化合物的晶体中,一定含 2020-05-14 …
下列说法中不正确的是()A.离子晶体中不一定含有金属元素B.晶格能越大,物质的硬度反而越小C.在含 2020-05-17 …
下列说法中不正确的是()A、离子晶体中不一定含有金属元素B、晶格能越大,物质的硬度反而越小C、在含 2020-05-17 …
用表示阿伏伽德罗常数,下列说法中正确的()A.1L1mol/L的醋酸溶液中离子总数为2NAB.0. 2020-06-18 …
为什么1molNa2O和Na2O2混合物中含阴阳离子总数为3NA朋友 我是不懂 它是混合物 但是为 2020-06-27 …
已知合金A由两种常见金属组成.为测定其组成,某同学做实验如下:请回答:(1)合金A中含有的金属是( 2020-07-25 …
下列说法正确的是()①具有规则几何外形的固体一定是晶体②含有阳离子的晶体一定是离子晶体③非极性分子中 2020-12-25 …