早教吧作业答案频道 -->化学-->
用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4•2H2O)的工业流程如图.己知:①草酸钴晶体难溶于水②RH为有机物(难电离)(1)滤渣I的主要成分
题目详情
用含钴废料(主要成分为Co,含有一定量的Ni、Al2O3、Fe、SiO2等)制备草酸钴晶体(CoC2O4•2H2O)的工业流程如图.己知:①草酸钴晶体难溶于水②RH为有机物(难电离)
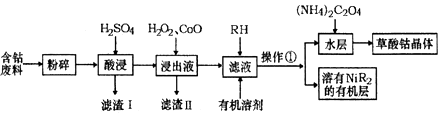
(1)滤渣I的主要成分是___(填化学式),写出一种能提高酸浸速率的措施___.
(2)操作①用到的主要仪器有___.
(3)H2O2是一种绿色氧化剂,写出加入H2O2后发生反应的离子方程式___.
(4)加入氧化钴的目的是___.
(5)草酸钴晶体分解后可以得到多种钴的氧化物(其中Co的化合价为+2、+3),取一定量钴的氧化物,用280mL 5mol/L盐酸恰好完全溶解,并得到CoCl2溶液和2.24L(标准状况)黄绿色气体,由此可确定该钴氧化物中Co、O的物质的量之比为___.
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-),测定溶液中C2O42-的浓度,写出此反应的离子方程式___;KMnO4 标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果___(填“偏高”、“偏低”或“无影响”).

(1)滤渣I的主要成分是___(填化学式),写出一种能提高酸浸速率的措施___.
(2)操作①用到的主要仪器有___.
(3)H2O2是一种绿色氧化剂,写出加入H2O2后发生反应的离子方程式___.
(4)加入氧化钴的目的是___.
(5)草酸钴晶体分解后可以得到多种钴的氧化物(其中Co的化合价为+2、+3),取一定量钴的氧化物,用280mL 5mol/L盐酸恰好完全溶解,并得到CoCl2溶液和2.24L(标准状况)黄绿色气体,由此可确定该钴氧化物中Co、O的物质的量之比为___.
(6)实验室可以用酸性KMnO4标准液滴定草酸根离子(C2O42-),测定溶液中C2O42-的浓度,写出此反应的离子方程式___;KMnO4 标准溶液常用硫酸酸化,若用盐酸酸化,会使测定结果___(填“偏高”、“偏低”或“无影响”).
▼优质解答
答案和解析
(1)用含钴废料,粉碎后用硫酸溶解,SiO2不与硫酸反应,滤渣Ⅰ为SiO2,提高硫酸的浓度、提高反应的温度、搅拌能提高酸浸速率;
故答案为:SiO2;提高硫酸的浓度、提高反应的温度、搅拌;
(2)通过操作①得到水层和有机层,则操作①为分液,分液需要的仪器有:分液漏斗、烧杯;
故答案为:分液漏斗、烧杯;
(3)H2O2氧化亚铁离子生成铁离子,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(4)加入氧化钴的目的是调节溶液的pH,使铁离子铝离子沉淀;
故答案为:调节溶液pH;
(5)取一定量钴的氧化物,用280mL 5mol/L盐酸恰好完全溶解,则n(Cl)=0.28L×5mol/L=1.4mol,有得到CoCl2溶液和2.24L(标准状况)黄绿色气体,n(Cl2)=
=0.1mol,故n(CoCl2)=0.6mol,则n(Co原子)总=0.6mol,
由电子守恒:Cl2~2e-~2Co3+,则n(Co3+)=2n(Cl2)=0.2mol,
所以固体中的n(Co2+)=0.6mol-0.2mol=0.4mol,
根据化合价为0,氧化物中n(O)=(0.2mol×3+0.4mol×2)÷2=0.7mol,
故该钴氧化物中n(Co):n(O)=0.6mol:0.7mol=6:7;
故答案为:6:7;
(6)用酸性KMnO4标准液滴定草酸根离子(C2O42-),发生氧化还原反应,离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++l0CO2↑+8H2O,KMnO4 标准溶液常用硫酸酸化,若用盐酸酸化,高锰酸钾会氧化盐酸中的氯离子,消耗高锰酸钾偏多,测定结果偏高;
故答案为:2MnO4-+5C2O42-+16H+=2Mn2++l0CO2↑+8H2O;偏高.
故答案为:SiO2;提高硫酸的浓度、提高反应的温度、搅拌;
(2)通过操作①得到水层和有机层,则操作①为分液,分液需要的仪器有:分液漏斗、烧杯;
故答案为:分液漏斗、烧杯;
(3)H2O2氧化亚铁离子生成铁离子,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;
(4)加入氧化钴的目的是调节溶液的pH,使铁离子铝离子沉淀;
故答案为:调节溶液pH;
(5)取一定量钴的氧化物,用280mL 5mol/L盐酸恰好完全溶解,则n(Cl)=0.28L×5mol/L=1.4mol,有得到CoCl2溶液和2.24L(标准状况)黄绿色气体,n(Cl2)=
| 2.24L |
| 22.4L/mol |
由电子守恒:Cl2~2e-~2Co3+,则n(Co3+)=2n(Cl2)=0.2mol,
所以固体中的n(Co2+)=0.6mol-0.2mol=0.4mol,
根据化合价为0,氧化物中n(O)=(0.2mol×3+0.4mol×2)÷2=0.7mol,
故该钴氧化物中n(Co):n(O)=0.6mol:0.7mol=6:7;
故答案为:6:7;
(6)用酸性KMnO4标准液滴定草酸根离子(C2O42-),发生氧化还原反应,离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++l0CO2↑+8H2O,KMnO4 标准溶液常用硫酸酸化,若用盐酸酸化,高锰酸钾会氧化盐酸中的氯离子,消耗高锰酸钾偏多,测定结果偏高;
故答案为:2MnO4-+5C2O42-+16H+=2Mn2++l0CO2↑+8H2O;偏高.
看了用含钴废料(主要成分为Co,含...的网友还看了以下:
求高手帮忙判断这四个络合物的磁矩!下列络合物中,磁矩最大的是(A)六氰合钴(Ⅲ)离子(B)六氰合铁 2020-06-03 …
下列哪些离子能与氨水作用生成配合物:二价钴离子,二价锰离子,二价镍离子,二价铁离子,二价铜离子,银 2020-06-21 …
在重结晶过程中有时要进行多次洗涤,在进行热过滤后,要用少量热溶剂冲洗一遍,其目的是什么?在晶体析出 2020-06-29 …
二硫苏糖醇能还原哪些金属离子比如1mM的DTT能把二价铜离子,锰离子,镁离子,钴离子,镍离子,钙离 2020-06-30 …
分析溶液中钴离子浓度时,遇到很多颜色变化无法解释,目前正在做一个分析镍钴混合液中钴含量分析的实验, 2020-07-02 …
在工业废渣中回收钴中,在酸性条件下,加碳酸钙除铁,反应原理是什么?如果生成Fe(OH)3,那么里面 2020-07-25 …
制氢氧化钴为什么不用3价钴离子直接加碱制取 2020-11-01 …
实验化学——四氯合钴(Ⅱ)离子与二氯化钴的区别那个,新课标里没怎么提过络合物,1.〔CoCl4〕2ˉ 2020-11-01 …
废旧钴酸锂镍离子电池主要含有Fe、Al、Cu的单质和LiCoO2,某化学小组同学设计如下实验流程分离 2020-11-01 …
0.01摩尔每升的钴离子溶液中,通入硫化氢,使其沉淀为硫化钴,分别求开始与完全沉淀时的pH 2020-11-01 …