早教吧作业答案频道 -->化学-->
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业.(1)某研究小组设计SnSO4制备路线如下:已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极
题目详情
硫酸亚锡(SnSO4)、四氯化锡(SnCl4)常用于印染和电镀工业.
(1)某研究小组设计SnSO4制备路线如下:
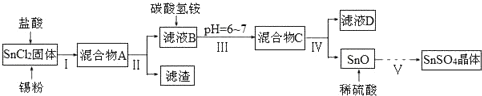
已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解.
①SnCl2酸溶后加入Sn粉的作用是___;
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有___;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为取最后一次洗涤液少许于试管中,滴加___,若___现象,则证明SnO中的Cl-已洗涤干净.
③步骤Ⅴ涉及到的操作有:a.过滤 b.洗涤 c.蒸发浓缩 d.冷却结晶 e.低温干燥,则其正确的操作顺序为___.(填字母序号)
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热.
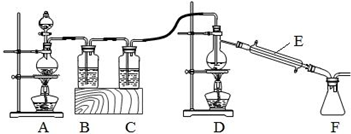
①装置C中应加入的试剂为___;仪器E的名称为___.
②反应开始生成SnCl4时,可以先熄灭___(填字母序号)处的酒精灯,理由是___.
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)___.
(1)某研究小组设计SnSO4制备路线如下:

已知:酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化;SnCl2极易水解.
①SnCl2酸溶后加入Sn粉的作用是___;
②步骤Ⅱ中用到的玻璃仪器除烧杯外还有___;步骤Ⅳ中需要洗涤固体SnO中含有的杂质,检验SnO中的Cl-是否洗涤干净的操作为取最后一次洗涤液少许于试管中,滴加___,若___现象,则证明SnO中的Cl-已洗涤干净.
③步骤Ⅴ涉及到的操作有:a.过滤 b.洗涤 c.蒸发浓缩 d.冷却结晶 e.低温干燥,则其正确的操作顺序为___.(填字母序号)
(2)实验室拟用以下装置,用熔融的金属锡与干燥纯净的氯气制取无水SnCl4(SnCl4熔点-33℃,沸点114.1℃,遇潮湿空气极易水解),此反应过程放出大量的热.

①装置C中应加入的试剂为___;仪器E的名称为___.
②反应开始生成SnCl4时,可以先熄灭___(填字母序号)处的酒精灯,理由是___.
③该实验装置设计尚存在缺陷,改进的方法是(包括仪器、试剂及连接位置等)___.
▼优质解答
答案和解析
(1)由于Sn2+易水解、易被氧化,加入盐酸,抑制Sn2+水解,加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,步骤Ⅱ为过滤,得SnCl2溶液,向其中加碳酸氢铵,调节溶液pH,使Sn元素以SnO形式沉淀,再过滤洗涤得纯净的SnO,加稀硫酸,得SnSO4溶液,加热浓缩、冷却结晶、过滤、洗涤,制得SnSO4晶体,滤液D中含有大量的NH4Cl等.
①加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,
故答案为:调节溶液pH,还防止Sn2+被氧化;
②步骤Ⅱ为过滤,用到的玻璃仪器除烧杯外还有漏斗、玻璃棒,
沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-,具体方案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀生成,说明洗涤干净
故答案为:漏斗、玻璃棒;滴加稀硝酸和AgNO3溶液,无白色沉淀生成;
③步骤Ⅴ是用硫酸溶解后,从溶液中获得晶体,滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥,制得SnSO4晶体,操作顺序为:cdabe,
故答案为:cdabe;
(2)由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,A制备氯气,B中盛放饱和氯化钠反应,除外HCl,C中盛放浓硫酸,干燥氯气,D中Sn与氯气反应生成SnCl4,F收集SnCl4.
①装置C中应加入的试剂为浓硫酸,仪器E的名称为冷凝管,故答案为:浓硫酸;冷凝管;
②熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行,可以先熄灭D处的酒精灯,
故答案为:D;熔融的金属锡与氯气反应过程中放出大量的热,能维持该反应继续进行;
③需要温度计;在装置F后应连接一个装有碱石灰(或氢氧化钠固体)的干燥管,需要防止空气中水蒸气加入F中,
故答案为:需要温度计;在装置F后应连接一个装有碱石灰(或氢氧化钠固体)的干燥管.
①加入Sn粉可以与盐酸反应,调节溶液pH,还防止Sn2+被氧化,
故答案为:调节溶液pH,还防止Sn2+被氧化;
②步骤Ⅱ为过滤,用到的玻璃仪器除烧杯外还有漏斗、玻璃棒,
沉淀为SnO表面附着着Cl-,要想检验滤渣是否洗涤干净,用硝酸、硝酸银溶液检验最后一次洗涤液中是否含有Cl-,具体方案为:取最后一次滤液少许于试管中,依次滴加足量硝酸、少量硝酸银溶液,观察到无白色沉淀生成,说明洗涤干净
故答案为:漏斗、玻璃棒;滴加稀硝酸和AgNO3溶液,无白色沉淀生成;
③步骤Ⅴ是用硫酸溶解后,从溶液中获得晶体,滤液经过加热浓缩、冷却结晶、过滤、洗涤、干燥,制得SnSO4晶体,操作顺序为:cdabe,
故答案为:cdabe;
(2)由于SnCl4易水解,制备中应在干燥环境中进行,制备的氯气中含有HCl、水蒸气,需要除去,防止Sn与HCl反应,SnCl4水解,A制备氯气,B中盛放饱和氯化钠反应,除外HCl,C中盛放浓硫酸,干燥氯气,D中Sn与氯气反应生成SnCl4,F收集SnCl4.
①装置C中应加入的试剂为浓硫酸,仪器E的名称为冷凝管,故答案为:浓硫酸;冷凝管;
②熔融锡与氯气化合的反应是放热反应,且放出的热足够此反应持续进行,可以先熄灭D处的酒精灯,
故答案为:D;熔融的金属锡与氯气反应过程中放出大量的热,能维持该反应继续进行;
③需要温度计;在装置F后应连接一个装有碱石灰(或氢氧化钠固体)的干燥管,需要防止空气中水蒸气加入F中,
故答案为:需要温度计;在装置F后应连接一个装有碱石灰(或氢氧化钠固体)的干燥管.
看了硫酸亚锡(SnSO4)、四氯化...的网友还看了以下:
.过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等.某化学兴趣小组 2020-04-09 …
Ⅰ.实验室用30%的双氧水溶液配制100g溶质质量分数为6%的双氧水溶液,需要加入水的体积为mL。 2020-05-13 …
Ⅰ.实验室用30%的双氧水溶液配制100g溶质质量分数为6%的双氧水溶液,需要加入水的体积为mL. 2020-05-13 …
科学老师做了如图1所示的“大象牙膏”实验:现象是涌出柱状的泡沫,被形象地称为“大象牙膏”,其原理主 2020-05-13 …
“鱼浮灵”主要成分是过碳酸钠(xNa2CO3•yH2O2).俗称固体双氧水.某兴趣小组对其进行以下 2020-06-14 …
家庭养观赏鱼时会在鱼缸里放点“鱼浮灵”,可使水中的含氧量迅速增加.“鱼浮灵”主要成分是过碳酸钠(x 2020-08-02 …
某学生学习了双氧水制氧气的实验后,想起自己家里也有一瓶消毒用双氧水,经查看发现已过期,但不知是否完全 2020-11-06 …
某消毒剂的主要成分是过氧乙酸(CH3COOOH)和双氧水,某实验室测定其中过氧乙酸含量的步骤如下:第 2020-11-10 …
质量分数为3%的医用双氧水难分解;但在双氧水中加入铁锈,双氧水就会迅速分解成氧气和水,反应结束后滤出 2020-11-20 …
为鼓励居民节约用水,某6实行阶梯水价,下表列车了该6居民自来水费d收费标准:用水量n(吨)0<n≤口 2020-11-28 …