早教吧作业答案频道 -->化学-->
摩尔盐是一种复盐,它易溶于水,不溶于乙醉,性质比一般亚铁盐稳定,不易被氧化.废铁屑为原料生产摩尔盐的主要流程如图:(1)反应I为了加快铁屑(过量)的溶解,可采取的措施是
题目详情
摩尔盐是一种复盐,它易溶于水,不溶于乙醉,性质比一般亚铁盐稳定,不易被氧化.废铁屑为原料生产摩尔盐的主要流程如图:
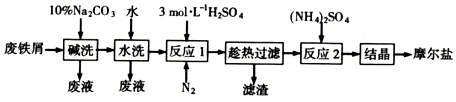
(1)反应I为了加快铁屑(过量)的溶解,可采取的措施是___(写出一种即可).
(2)废铁屑中含有少量氧化铁,无需在制备前除去,理由是___(用离子方程式回答).
(3)为确定摩尔盐的化学式,设计以下实验:称取23.52g新制摩尔盐,溶于水配制成10 液,将所得溶分成两等份.一份加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;用足童稀盐沉淀物,充分反应后过滤、洗涤和干燥,得白色固体13.98g.另一份用0.2000mol•L-1K2Cr2O7酸性溶液滴定,当Cr2072-恰好完全被还原为Cr3+时,消耗K2Cr207溶液的体积为25.(已知 6Fe2++Cr2072-+14H+=6Fe3++2Cr2++7H20)
①在上述实验过程中,确定Ba(OH)2溶液已经足量的方法是___.
②通过计算确定摩尔盐的化学式.(写出计算过程)

(1)反应I为了加快铁屑(过量)的溶解,可采取的措施是___(写出一种即可).
(2)废铁屑中含有少量氧化铁,无需在制备前除去,理由是___(用离子方程式回答).
(3)为确定摩尔盐的化学式,设计以下实验:称取23.52g新制摩尔盐,溶于水配制成10 液,将所得溶分成两等份.一份加入足量Ba(OH)2溶液,并微热,逸出能使湿润的红色纸变蓝的气体,同时生成白色沉淀,随即沉淀变为灰绿色,最后带有红褐色;用足童稀盐沉淀物,充分反应后过滤、洗涤和干燥,得白色固体13.98g.另一份用0.2000mol•L-1K2Cr2O7酸性溶液滴定,当Cr2072-恰好完全被还原为Cr3+时,消耗K2Cr207溶液的体积为25.(已知 6Fe2++Cr2072-+14H+=6Fe3++2Cr2++7H20)
①在上述实验过程中,确定Ba(OH)2溶液已经足量的方法是___.
②通过计算确定摩尔盐的化学式.(写出计算过程)
▼优质解答
答案和解析
(1)可以加入Cu或CuSO4,形成原电池,加快反应速率,
故答案为:Cu或CuSO4;
(2)废铁中含氧化铁,无需制备前除去,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁,离子方程式为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+;
(3)①氢氧化钡和硫酸铁铵反应生成硫酸钡沉淀和氢氧化铁沉淀及氨气,若氢氧化钡不足,则溶液中存在硫酸根离子,故继续加入氢氧化钡沉淀,若无沉淀生成,证明氢氧化钡过量,具体操作为:再加入一滴Ba(OH)2溶液,不再生成新的沉淀,则说明氢氧化钡过量;
故答案为:再加入一滴Ba(OH)2溶液,不再生成新的沉淀;
②根据题意,白色沉淀的物质的量为
=0.06moln(SO42-)=0.06mol,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) 0.2000mol•L-1×0.025L,
所以n(Fe2+)=0.005 mol×6=0.03mol,
根据电荷守恒:n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.06mol,
n(H2O)=
=0.18 mol,
所以n(SO42-):n(Fe2+):n(NH4+):n(H2O)=0.06mol:0.03mol:0.06mol:0.18mol=2:1:2:6,所以莫尔盐的化学式为(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O],
故答案为:莫尔盐的化学式为(NH4)2Fe(SO4)2•6H2O.
故答案为:Cu或CuSO4;
(2)废铁中含氧化铁,无需制备前除去,因最终溶液是FeSO4溶液,氧化铁和硫酸生成硫酸铁、铁和硫酸铁生成硫酸亚铁,离子方程式为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+;
(3)①氢氧化钡和硫酸铁铵反应生成硫酸钡沉淀和氢氧化铁沉淀及氨气,若氢氧化钡不足,则溶液中存在硫酸根离子,故继续加入氢氧化钡沉淀,若无沉淀生成,证明氢氧化钡过量,具体操作为:再加入一滴Ba(OH)2溶液,不再生成新的沉淀,则说明氢氧化钡过量;
故答案为:再加入一滴Ba(OH)2溶液,不再生成新的沉淀;
②根据题意,白色沉淀的物质的量为
| 13.98g |
| 233g/mol |
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
6 1
n(Fe2+) 0.2000mol•L-1×0.025L,
所以n(Fe2+)=0.005 mol×6=0.03mol,
根据电荷守恒:n(NH4+)+2n(Fe2+)=2n(SO42-),n(NH4+)=0.06mol,
n(H2O)=
| ||
| 18g/mol |
所以n(SO42-):n(Fe2+):n(NH4+):n(H2O)=0.06mol:0.03mol:0.06mol:0.18mol=2:1:2:6,所以莫尔盐的化学式为(NH4)2Fe(SO4)2•6H2O[或(NH4)2SO4•FeSO4•6H2O],
故答案为:莫尔盐的化学式为(NH4)2Fe(SO4)2•6H2O.
看了摩尔盐是一种复盐,它易溶于水,...的网友还看了以下:
100克质量分数为20%的食盐溶液中含食盐几克?含水几克?如果要将它变成20℃的食盐饱和溶液,需要 2020-04-09 …
有两个装满盐水的桶,大桶内盐水60千克,含盐4%,小桶内盐水40千克,含盐20%,各取出多少千克分 2020-04-27 …
青霉素是一元酸,它的钠盐的1国际单位的质量为6.00*10^-7g,它的钾盐1国际单位的质量为6. 2020-05-12 …
莫尔盐[(NH4)2SO4・FeSO4・6H2O]空气中比一般亚铁盐稳定,是化学分析中常用的还原剂 2020-05-14 …
莫尔盐[(NH4)2SO4•FeSO4•6H2O]在空气中比一般亚铁盐稳定,是化学分析中常用的还原 2020-05-14 …
现有含盐率是百分之十五的盐水500克,要使它的含盐率达到百分之十,应向盐水中加入多少克盐. 2020-05-16 …
海洋是人类最大的资源宝库,人类在逐步的开发和利用它.现有一包从海水获得的粗盐,已经经过初步的提纯. 2020-05-17 …
针对前一阵的“抢盐风波”,小林对生活中的加碘自然盐进行了探究.问题一:食盐加碘可以有效地预防.问题 2020-05-17 …
在海水淡化稳态过程中,海水含盐3.5%,每小时生产淡水1000kg,排放的废盐水浓度8%.试用物料 2020-06-05 …
一道数学题,额,一瓶10千克的盐水,它的含盐率是20%,加入含盐率为10%的盐水后,含盐量下降为1 2020-06-06 …