早教吧作业答案频道 -->化学-->
软锰矿(主要成份为MnO2)可用于制备锰及其化合物,如图为现代冶炼软锰矿制化学纯MnO2的工艺流程图.(1)软锰矿还能在C6H12O6和50%的H2SO4条件下还原浸出得到MnSO4,写出该反应的离子方程
题目详情
软锰矿(主要成份为MnO2)可用于制备锰及其化合物,如图为现代冶炼软锰矿制化学纯MnO2的工艺流程图.
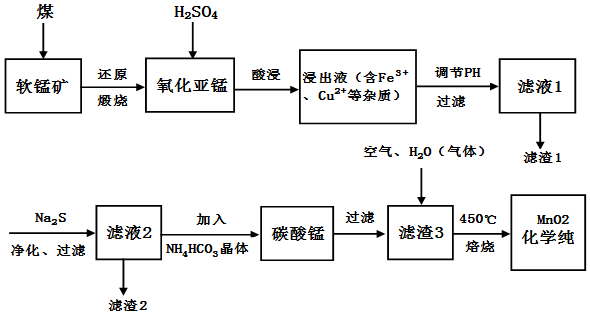
(1)软锰矿还能在C6H12O6和50%的H2SO4条件下还原浸出得到MnSO4,写出该反应的离子方程式:___,同上述流程相比此法的优点是___.
(2)写出能提高氧化亚锰(MnO)浸出率的措施:___.
(3)滤渣1和滤渣2分别为___、___(填化学式).
(4)写出滤液2加入NH4HCO3晶体制碳酸锰的化学方程式___;写出由滤渣3制化学纯MnO2的化学方程式___.
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)⇌Mn(OH)2(s)+CO
(aq),t℃时,计算该反应的平衡常数K=___.(填数值)
(6)剩余的MnCO3及低价氧化亚锰,经H2SO4溶出,氯酸钠重质化,再经洗涤,烘干也可制得化学纯MnO2(过程中会有黄绿色气体放出),写出该反应的离子方程式___.

(1)软锰矿还能在C6H12O6和50%的H2SO4条件下还原浸出得到MnSO4,写出该反应的离子方程式:___,同上述流程相比此法的优点是___.
(2)写出能提高氧化亚锰(MnO)浸出率的措施:___.
(3)滤渣1和滤渣2分别为___、___(填化学式).
(4)写出滤液2加入NH4HCO3晶体制碳酸锰的化学方程式___;写出由滤渣3制化学纯MnO2的化学方程式___.
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s)+2OH-(aq)⇌Mn(OH)2(s)+CO
| 2- 3 |
(6)剩余的MnCO3及低价氧化亚锰,经H2SO4溶出,氯酸钠重质化,再经洗涤,烘干也可制得化学纯MnO2(过程中会有黄绿色气体放出),写出该反应的离子方程式___.
▼优质解答
答案和解析
(1)软锰矿与C6H12O6和50%的H2SO4条件下生成MnSO4,锰元素化合价降低,则碳元素化合价升高生成二氧化碳,反应为:12MnO2+24H++C6H12O6=12Mn2++6CO2+18H2O;该方法能耗低、操作更简便、转化率高;
故答案为:12MnO2+24H++C6H12O6=12Mn2++6CO2+18H2O;能耗低、操作更简便、转化率高;
(2)适当升高反应体系温度,及适当增大H2SO4浓度可提高氧化亚锰(MnO)浸出率;
故答案为:适当升高反应体系温度,及适当增大H2SO4浓度;
(3)浸出液含有Fe3+、Cu2+等杂质,调节溶液的pH,将 Fe3+以Fe(OH)3沉淀下来,向滤液中加入硫化钠,可以将铜离子形成硫化物沉淀下来,故滤渣1为Fe(OH)3;滤渣2为CuS;
故答案为:Fe(OH)3;CuS;
(4)滤液2主要成分为硫酸锰,加入NH4HCO3晶体生成碳酸锰、硫酸铵、二氧化碳和水,反应为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;碳酸锰高温下被氧气氧化为二氧化锰,反应为:2MnCO3+O2
MnO2+2CO2;
故答案为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;2MnCO3+O2
MnO2+2CO2;
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,反应MnCO3(s)+2OH-(aq)⇌Mn(OH)2(s)+CO32-(aq),平衡常数K=
=
•
=
=
=102.5;
故答案为:102.5;
(6)锰离子在酸性条件下被氯酸根离子氧化为二氧化锰,氯酸根离子被还原为氯离子,离子方程式为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+;
故答案为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+.
故答案为:12MnO2+24H++C6H12O6=12Mn2++6CO2+18H2O;能耗低、操作更简便、转化率高;
(2)适当升高反应体系温度,及适当增大H2SO4浓度可提高氧化亚锰(MnO)浸出率;
故答案为:适当升高反应体系温度,及适当增大H2SO4浓度;
(3)浸出液含有Fe3+、Cu2+等杂质,调节溶液的pH,将 Fe3+以Fe(OH)3沉淀下来,向滤液中加入硫化钠,可以将铜离子形成硫化物沉淀下来,故滤渣1为Fe(OH)3;滤渣2为CuS;
故答案为:Fe(OH)3;CuS;
(4)滤液2主要成分为硫酸锰,加入NH4HCO3晶体生成碳酸锰、硫酸铵、二氧化碳和水,反应为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;碳酸锰高温下被氧气氧化为二氧化锰,反应为:2MnCO3+O2
| ||
故答案为:MnSO4+2NH4HCO3=MnCO3+(NH4)2SO4+CO2↑+H2O;2MnCO3+O2
| ||
(5)已知,t℃时Ksp[Mn(OH)2]=10-12.7,Ksp(MnCO3)=10-10.2,反应MnCO3(s)+2OH-(aq)⇌Mn(OH)2(s)+CO32-(aq),平衡常数K=
| c(CO32-) |
| c2(OH-) |
| c(CO32-) |
| c2(OH-) |
| c(Mn2+) |
| c(Mn2+) |
| Ksp(MnCO3) |
| Ksp[Mn(OH)2] |
| 10-10.2 |
| 10-12.7 |
故答案为:102.5;
(6)锰离子在酸性条件下被氯酸根离子氧化为二氧化锰,氯酸根离子被还原为氯离子,离子方程式为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+;
故答案为:5Mn2++2ClO3-+4H2O=5MnO2+Cl2+8H+.
看了软锰矿(主要成份为MnO2)可...的网友还看了以下:
______是为解决实际应用问题而编写的软件的总称。如各种字处理软件、图形软件、学习软件和游戏软件 2020-05-23 …
1.蔗糖在充足的氧气中燃烧,应该生成什么?2.宋代初期,人们发现江西上饶有一苦泉,蒸发这种苦泉会得 2020-07-06 …
工业上用黄铜矿冶炼铜及对炉渣综合利用的一种工艺流程如下:(1)冶炼过程中得到Cu2O和Cu的混合物 2020-07-14 …
实验室用一氧化碳与氧化铁反应冶炼金属实验结束时不需现将连接澄清石灰水的导管断实验室用一氧化碳与氧化 2020-07-22 …
(2013•德州模拟)钠及其化合物具有广泛的用途.(1)工业上可利用反应Na(l)+KCl(l)⇌K 2020-11-13 …
我国是现代湿法冶金术的先驱,早在西汉时期刘安在《淮南万毕术》中写到“曾青得铁则化为铜”,这句话就是指 2020-11-20 …
我国是现代湿法炼铜的先驱,早在西汉时期刘安在《淮南万毕术》中写到“曾青得铁则化为铜”,这句话就是利用 2020-11-25 …
下列各句中,没有语病的一句是[]A.在实施新课程改革的背景下,学校应该积极组织学生开展丰富多彩的活动 2021-01-19 …
下列金属冶炼的方法错误的是()A.加热分解Ag2O冶炼银B.用CO还原氧化铁冶炼铁C.钠与Mg2Cl 2021-02-09 …
利用一氧化碳和磁铁矿(主要成分为Fe3O4)反应冶炼生铁的化学方程式为;生铁经过进一步冶炼可得到钢, 2021-02-19 …