高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:Ⅰ(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是
高锰酸钾在实验室和工农业生产中有广泛的用途,实验室以二氧化锰为主要原料制备高锰酸钾,其部分流程如下:

Ⅰ(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是 (用化学程式表示)。
(2)第④步通![]() 人适量CO2,发生反应生成KMn04和Mn02和碳酸盐,则发生反应的离子方程式为__________________________________________________________________。
人适量CO2,发生反应生成KMn04和Mn02和碳酸盐,则发生反应的离子方程式为__________________________________________________________________。
(3)第⑥步加热浓缩至液面有细小晶体析出时,停止加热,冷却结晶、过滤、洗涤、干燥,干燥过程中,温度不宜过高,其原因是
(4)H2O2和KMn04都是常用的强氧化剂,若向H2O2溶液中滴加酸性高锰酸钾溶液,则酸性高锰酸钾溶液会褪色,该反应中氧化产物与还原产物的物质的量之比为 。
Ⅱ.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的![]() 性质。
性质。
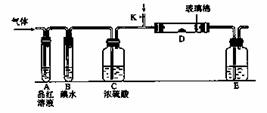
(5)若从左端分别通人SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);
(6)若装置B中装有5.0 mL l.0 mol/L的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子![]() ,该反应的化学方程式为
,该反应的化学方程式为 ![]()
(7)探究SO2的性质时,E装置![]() 中以NaOH溶液吸收尾气,实验结束后,E装置中可能含有的溶质为_______________________________(以化学式作答).
中以NaOH溶液吸收尾气,实验结束后,E装置中可能含有的溶质为_______________________________(以化学式作答).
【答案】(1)SiO2+2KOH = K2SiO3 +H2O (2)3MnO42-+2CO2=2MnO4- + MnO2+2CO32-
(3)防止温度过高, KMn04受热分解。 (4) 5:2
(5 ) 相同 (6 ) 5Cl2+I2+6H2O =2HIO3+10HCl
(7)NaOH 、Na2SO3 、 Na2SO4
【解析】
试题分析:Ⅰ(1)由于KOH是强碱,在加热及高温时容易与玻璃、陶瓷中的SiO2发生反应,该反应的方程式为:SiO2+2KOH![]() K2SiO3+H2O。所以加热熔融KClO3和KOH的混合物应在铁坩埚中进行。
K2SiO3+H2O。所以加热熔融KClO3和KOH的混合物应在铁坩埚中进行。
(2)根据题意结合原子守恒和电荷守恒,可得该反应的方程式为:3MnO42-+2C![]() O2=2MnO4-+MnO2↓+2CO32-。(3)第⑥ 步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥。KMnO4受热容易发生分解反应:2KMnO4
O2=2MnO4-+MnO2↓+2CO32-。(3)第⑥ 步加热浓缩至液面有细小晶体析出时.停止加热.冷却结晶、过滤、洗涤、干燥。KMnO4受热容易发生分解反应:2KMnO4![]() K2MnO4+MnO2+O2↑。为了防止KMnO4的分解,所以在干燥时温度不宜过高。(4)KMnO4和H2O2都有强的氧化性,但KMnO4的氧化性更强,所以二者发生反应时H2O2作还原剂,把KMnO4还原为无色的Mn2+,而使溶液褪色,2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O,氧化产物与还原产物的物质的量之比为5:2。
K2MnO4+MnO2+O2↑。为了防止KMnO4的分解,所以在干燥时温度不宜过高。(4)KMnO4和H2O2都有强的氧化性,但KMnO4的氧化性更强,所以二者发生反应时H2O2作还原剂,把KMnO4还原为无色的Mn2+,而使溶液褪色,2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O,氧化产物与还原产物的物质的量之比为5:2。
Ⅱ(5)二氧化硫能和有色物质反应生成无色物质,所以二氧化硫有漂白性;氯气和水反应生成次氯酸,次氯酸具有强氧化性,能使有色物质褪色,所以若从左端分别通入SO2和Cl2,装置A中观察到的现象相同,都使品红褪色;(6)装置B中装有5.0mL 1.0mol•L-1的碘水,当通入足量Cl2完全反应后,共转移了5.0×10-2 mol电子,故I元素在氧化产物中的化合价为5.0×10-2/(0.005×1.0)=5,故氧化产物为HIO3,氯气被还原为HCl,反应方程式为:5Cl2+I2+6H2O=10HCl+2HIO3
(7)以NaOH溶液吸收尾气,NaOH溶液一定过量,SO2和NaOH反应产生亚硫酸钠,亚硫酸钠易被空气中的氧气氧化生成硫酸钠,所以实验结束后,E装置中可能含有的溶质为NaOH 、Na2SO3 、 Na2SO4
考点:SO2的性质、化学实验的基本操作
.小明和丽丽正在用手工做“干花”,这次一共做了300枝花,在加工完成60枝花后,他们改进了加工方法 2020-04-26 …
MnO2是一种重要的化工试剂,在合成工业用途广泛,在实验室我们也经常发现它的身影.(1)实验室用双 2020-05-13 …
硫及其化合物是重要的化工原料,在工农业生产应用广泛.(1)二氯亚砜(SOCl2)在有机合成工业用做 2020-05-13 …
物理知识应用广泛,在破案中也常用到它物理知识运用广泛,在破案工作中也常用到它,在某海滩案发现场留下 2020-05-23 …
图甲为一天然池塘的食物网简图,某饲养者将此池塘改造成一人工鱼塘,主要食物链如图乙所示.已知饲养者在 2020-07-10 …
本工程正负0.00为室内地面标高,相当于测量标高5.040米.特别是最后一句;相当于测量标高?我们现 2020-11-12 …
求翻译急!用翻译软件的就算了随着科学技术的进步,网络视频监控技术已被广泛地应用到诸多行业中,在工程领 2020-11-13 …
对于技术革新的推广,在下列几种情况下分别建立建模:(1)推广工作通过已经采用新技术的人进行,推广速度 2020-11-22 …
我们知道,在用电工仪表进行测量时,应该注意正确读数.而表的指针和刻度盘间总有一些空隙,由于这个空隙的 2020-12-05 …
英语翻译随着计算机技术在制造领域的广泛应用,特别是数字化测量技术的迅猛发展,逆向工程技术的应用前景越 2020-12-15 …